
 某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应).
某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应).| 碳酸盐 | CaCO3 | SrCO3 | BaCO3 |
| 热分解温度/℃ | 900 | 1172 | 1360 |
| 阳离子半径/pm | 99 | 112 | 135 |
分析 (1)A位于顶点、B位于体心,O位于面心,结合均摊法计算;晶胞中与A最近的氧原子位于同一平面内的面心和定点,每个晶胞中有$\frac{3}{2}$个O与A距离最近;
(2)Cr元素为24号元素,原子核外有24个电子,所以核外电子排布式为:1s22s22p63s23p63d54s1;
(3)N和O的价电子排布式分别为2s22p3、2s22p4,以此判断未成对电子数;
(4)从表格中得出:这些物质的阴离子是相同的,均为碳酸根,阳离子的半径越大,分解温度越高;
(5)钙的晶胞为面心立方最密堆积,则晶胞中含有Ca的数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,边长为a pm,则晶胞的体积为(a×10-10cm)3=a3×10-30cm3,根据ρ=$\frac{m}{V}$计算密度;
解答 解:(1)A位于顶点、B位于体心,O位于面心,则晶胞中A的个数为8×$\frac{1}{8}$=1,B的个数为1,O的个数为6×$\frac{1}{2}$=3,则化学式为ABO3,晶胞中与A最近的氧原子位于同一平面内的面心和定点,每个晶胞中有$\frac{3}{2}$个O与A距离最近,而A为8个晶胞共有,则与A原子配位的氧原子数目为8×$\frac{3}{2}$=12,
故答案为:ABO3;12;
(2)Cr元素为24号元素,原子核外有24个电子,所以核外电子排布式为:1s22s22p63s23p63d54s1,每个电子的运动状态都不同,则有24种不同的电子,
故答案为:1s22s22p63s23p63d54s1;24;
(3)N和O的价电子排布式分别为2s22p3、2s22p4,则未成对的电子数目比为3:2,
故答案为:3:2;
(4)从表格中得出:这些物质的阴离子是相同的,均为碳酸根,阳离子的半径越大,分解温度越高,由于钙离子由于半径小和氧离子结合更为容易,氧化钙晶格能大,所以碳酸钙分解温度低,
故答案为:碳酸盐的热分解是由于晶体中的阳离子结合碳酸根中的氧离子,使碳酸根分解为二氧化碳分子的结果.钙离子由于半径小和氧离子结合更为容易,氧化钙晶格能大,所以碳酸钙分解温度低;
(5)钙的晶胞为面心立方最密堆积,则晶胞中含有Ca的数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,边长为a pm,则晶胞的体积为(a×10-10cm)3=a3×10-30cm3,根据ρ=$\frac{m}{V}$可知,ρ=$\frac{\frac{40g/mol×4}{{N}_{A}}}{{a}^{3×}10{\;}^{-30}cm{\;}^{3}}$=$\frac{1.6×1{0}^{32}}{{N}_{A}•{a}^{3}}$g•cm-3,
故答案为:$\frac{1.6×1{0}^{32}}{{N}_{A}•{a}^{3}}$.
点评 本题以科学研究钙钛型复合氧化物作背景,考查学生对电子排布、晶胞计算等知识,侧重于学生的分析、计算能力的考查,难度中等,是对物质结构基础知识和应用能力考查,基础性较强,重点突出.


科目:高中化学 来源: 题型:解答题

| 仪器标号 | 1 | 2 | 3 | 4 | 5 |
| 试剂标号 | E | AFG | C | G | I |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
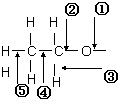 乙醇分子中各化学键如图所示:
乙醇分子中各化学键如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
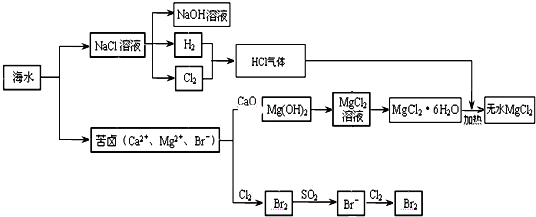
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 的键线式可写作
的键线式可写作 ,某有机物的键线式为
,某有机物的键线式为 ,其名称正确的是( )
,其名称正确的是( )| A. | 5-乙基-2-己烯 | B. | 2-甲基庚烯 | C. | 3-甲基-5-庚烯 | D. | 5-甲基-2-庚烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化三碳的电子式为:O::C::C::C::O: | |
| B. | C3O2、CO、CO2都是碳的氧化物 | |
| C. | C3O2和CO一样可以燃烧生成CO2 | |
| D. | C3O2不是碳酸的酸酐 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ═CH-CHO
═CH-CHO +CO$→_{氢化铝}^{HCl}$
+CO$→_{氢化铝}^{HCl}$

 +CH3CHO$\stackrel{稀碱}{→}$
+CH3CHO$\stackrel{稀碱}{→}$ .
.
 $→_{反应条件1}^{G}$H$\stackrel{浓硫酸}{→}$
$→_{反应条件1}^{G}$H$\stackrel{浓硫酸}{→}$ 试剂G的结构简式是CH3CH2CHO.
试剂G的结构简式是CH3CH2CHO.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com