
表是元素周期表的一部分,回答下列有关问题:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | Ⅷ |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)写出下列元素符号:① ;⑥ .
(2)画出⑤原子的结构示意图: .
③和⑧元素形成的化合物中含 键.(写化学键类型)
(3)在①﹣﹣⑨的元素中,金属性最强的元素是 ,非金属性最强的元素是 ,最不活泼的元素是 .(均用元素符号表示)
(4)⑧的最高价氧化物对应的水化物化学式是
(5)元素⑦与元素⑧相比,非金属性较强的是 (用元素符号表示),用一化学反应方程式表达这一事实 .
考点:
元素周期律和元素周期表的综合应用.
分析:
(1)由元素在周期表中的位置可知,①为N,②为F,③为Na,④为Mg,⑤为Al,⑥为Si,⑦为S,⑧为Cl,⑨为Ar;
(2)⑤为Al,原子核外有13个电子,有3个电子层,各层电子数为2、8、3;
③和⑧元素形成的化合物为NaCl;
(3)同周期从左向右元素的金属性减弱、非金属性增强,同主族从上到下元素的金属性增强、非金属性减弱;稀有气体原子最外层为稳定结构,化学性质最不活泼;
(4)⑧的最高价氧化物对应的水化物为高氯酸;
(5)同周期从左向右元素的非金属性增强,可以利用单质之间的相互置换验证.
解答:
解:(1)由元素在周期表中的位置可知,①为N,②为F,③为Na,④为Mg,⑤为Al,⑥为Si,⑦为S,⑧为Cl,⑨为Ar,故答案为:N;Si;
(2)⑤为Al,原子核外有13个电子,有3个电子层,各层电子数为2、8、3,原子结构示意图为: ;
;
③和⑧元素形成的化合物为NaCl,由活泼金属与活泼非金属性组成,含有离子键,
故答案为: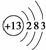 ;离子键;
;离子键;
(3)同周期从左向右元素的金属性减弱、非金属性增强,同主族从上到下元素的金属性增强、非金属性减弱,上述元素中Na的金属性最强,F的非金属性最强,稀有气体Ar原子最外层为稳定结构,化学性质最不活泼,
故答案为:K;F;Ar;
(4)⑧的最高价氧化物对应的水化物为高氯酸,化学式为HClO4,故答案为:HClO4;
(5)同周期自左而右非金属性增强,故非金属性Cl>S,可以利用单质之间的相互置换进行验证,相应方程式为Na2S+Cl2=S↓+2NaCl,
故答案为:Cl>S;Na2S+Cl2=S↓+2NaCl.
点评:
本题考查元素周期表与元素周期律,侧重对元素周期律的考查,注意理解掌握金属性、非金属性强弱比较及实验事实.


科目:高中化学 来源: 题型:
(1)BCl3和NCl3中心原子的杂化方式分别为 和 .第一电离能介于B、N之间的第二周期元素有 种.
(2)若BCl3与XYm通过B原子与X原子间的配位健结合形成配合物,则该配合物中提供孤对电子的原子是 .
(3)BF3与一定量水形成(H2O)2•BF3晶体Q,Q在一定条件下可转化为R:
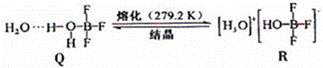
①晶体Q中各种微粒间的作用力不涉及 (填序号).
a.离子键 b.共价键 c.配位键 d.氢键e.范德华力
②R中阳离子的空间构型为 ,阴离子的中心原子轨道采用 杂化.
查看答案和解析>>
科目:高中化学 来源: 题型:
迷迭香酸具有抗氧化、延缓衰老、减肥降脂等功效,它的结构简式为:
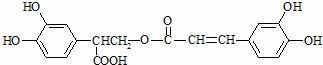
以邻苯二酚为原料合成迷迭香酸的路线为:
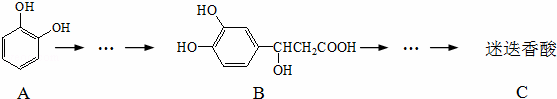
下列说法正确的是( )
|
| A. | 有机物A分子中所有原子一定在同一平面上 |
|
| B. | 有机物B可以发生取代、加成、消去、氧化反应 |
|
| C. | 有机物C在稀硫酸催化下水解的一种产物是B |
|
| D. | 1 mol B与足量的NaOH溶液反应,最多可消耗4 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
镁、铝、铜三种金属粉末混合物,加入过量盐酸充分反应,过滤后向滤液中加入过量烧碱溶液,再过滤,滤液中存在的离子有( )
|
| A. | [Al (OH)4]﹣ | B. | Cu2+ | C. | Al3+ | D. | Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
分布在三个不同短周期的四种元素A、B、C、D的原子序数依次增大,其中B、C同周期,A、D同主族.常温下,BA3溶液的显碱性;C是地壳中含量最高的元素;D是所在周期原子半径最大的元素.下列说法正确的是( )
|
| A. | 原子半径:D>C>B>A |
|
| B. | 气态氢化物的热稳定性:HmB>HnC |
|
| C. | 由A、B、C三种元素形成的化合物均只含有共价键,不含离子键 |
|
| D. | 单质D与水反应放出氢气,当转移2NA个电子时,产生氢气的体积为22. 4升(标准状况) |
查看答案和解析>>
科目:高中化学 来源: 题型:
中学阶级介绍的电解原理的应用主要有三种:一是氯碱工业、二是电解精炼铜、三是电解冶金。下列关于这三个工业生产的描述中正确的是
A.电解精炼铜时,负极反应式:Cu2++2e- Cu
Cu
B.氯碱工业和电解精炼铜中,阳极都是氯离子放电放出氯气
C.在氯碱工业中,电解池中的阴极产生的是H2, NaOH在阳极附近产生
D.电解精炼铜时,应用粗铜作阳极、精铜作阴极,可溶性铜盐作电解质溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
不锈钢以其优异的抗腐蚀性能越来越受到人们的青睐,它主要是由铁、铬、镍、铜、碳等元素所组成的合金。
Ⅰ.氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示。
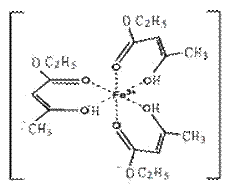
(1)此配合物中,铁离子的价电子排布式为 。
(2)此配合物的-C2H5中C-H间形成化学键的原子轨道分别是 ; 。
Ⅱ.(2)金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)n ,与Ni(CO)n中配体互为等电子体的离子的化学式为 (写出一个即可)。
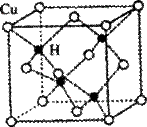
(2)铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途。已知CuH晶体结构单元如图所示。该化合物的的密度为ρg/cm3,阿伏加德罗常数的值为NA,则该晶胞中Cu原子与H原子之间的最短距离为 cm(用含ρ和NA的式子表示)。
Ⅲ.硼元素在化学中有很重要的地位,硼及其化合物广泛应用于永磁材料、超导材料、富燃料材料、复合材料等高新材料领域应用。
(1)三氟化硼在常温常压下为具有刺鼻恶臭和强刺激性的无色有毒腐蚀性气体,其分子的立体构型为 ,B原子的杂化类型为 。
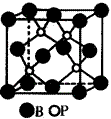
(2)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层。下图示意的是磷化硼的晶体结构单元,则磷化硼的化学式为 ,微粒间存在的作用力为 。
(3)正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子间通过氢键相连(如下图)。
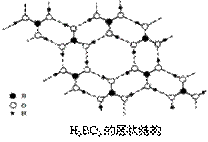
①1 mol H3BO3的晶体中有 mol氢键。
②硼酸溶于水应生成弱电解质一水合硼酸H2O·B(OH)3,它电离生成少量[B(OH)4]- 和的H+ 离子。则硼酸为 元酸,[B(OH)4]-含有的化学键类型为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
120℃时,1体积某烃和4体积O2混和,完全燃烧后恢复到原来的温度和压强,体积不变,该烃分子式中所含的碳原子数不可能是( )
|
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,某化合物W受热分解:2W A↑+2B↑+4C↑,测得反应后生成的混合气体是相同条件下等体积H2质量的11.43倍,则W的摩尔质量是( )
A↑+2B↑+4C↑,测得反应后生成的混合气体是相同条件下等体积H2质量的11.43倍,则W的摩尔质量是( )
A. 11.43 B. 22.86g/mol C. 80.01 D. 80.01g/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com