
(本题共12分)元素周期表中ⅦA族元素的单质及其化合物的用途广泛。
23.与氯元素同族的短周期元素的原子,其核外能量最高的电子所处的电子亚层是 ;
24.碘元素在元素周期表中的位置是 ;为防缺碘,食盐中常添加碘酸钾,该物质内存在 键(填化学键类型)。
25.溴单质是唯一常温下呈液态的非金属单质,它的电子式是 ;液溴的保存通常采取的方法是 。
26.通过比较___________或________________可以判断氯、溴两种元素非金属性强弱。
27.工业上,通过如下转化可制得KClO3晶体:

①配平I中反应的总化学方程式,并标出电子转移的方向和数目:
□NaCl + □H2O  □NaClO3 + □
□NaClO3 + □
②II反应过程能析出KClO3晶体而无其它晶体析出的原因是 。
28.CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101kPa下,已知该反应消耗1 mol CuCl(s),放热44.4 kJ,该反应的热化学方程式是_________________________。
23.2p (1分) 24.第五周期ⅦA族(1分) 离子键、共价键(1分)
25. (1分) 水封在棕色瓶中,密闭保存(1分)
(1分) 水封在棕色瓶中,密闭保存(1分)
26.HCl和HBr的气态氢化物的热稳定性、HClO4和HBrO4的酸性 (2分)(合理即可)
27.① 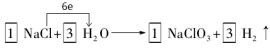 (H2 、系数1分,方向数目1分)
(H2 、系数1分,方向数目1分)
②室温下,氯酸钾在水中的溶解度明显小于其它晶体 (1分)
28.4CuCl(s) + O2(g)=2CuCl2(s) + 2CuO(s)ΔH=—177.6kJ/mol (2分)
【解析】
试题分析:23.与氯元素同族的短周期元素F元素的原子核外有9个电子,其核外电子排布式是1s22s22p5。可见其能量最高的电子所处的电子亚层是2p亚层;
24.53号元素碘元素核外有5个电子层,最外层有7个电子,所以在元素周期表中的位置是第五周期ⅦA族;为防缺碘,食盐中常添加碘酸钾,该物质是离子化合物,内存在离子键、极性共价键;
25.溴单质是唯一常温下呈液态的非金属单质,它是双原子分子,两个原子共用一对电子,都达到8个电子的稳定结构。它的电子式是 ;液溴容易挥发,由于其密度比水大,在水中溶解度不大,所以液溴通常保存采取在棕色瓶内,并加水形成水封,密封保存。
;液溴容易挥发,由于其密度比水大,在水中溶解度不大,所以液溴通常保存采取在棕色瓶内,并加水形成水封,密封保存。
26.元素的非金属性越强,其相应的氢化物的稳定性就越强。最高价的含氧酸的酸性也越强。所以可以通过比较HCl和HBr的气态氢化物的热稳定性、HClO4和HBrO4的酸性可以判断氯、溴两种元素非金属性强弱。
27.①由于在反应中Cl元素的化合价升高,则根据氧化还原反应的规律,还应该有元素的化合价降低,只有H元素符号该性质,得到电子变为H2,结合电子守恒及原子守恒可得方程式为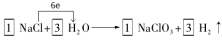
②II反应过程能析出KClO3晶体而无其它晶体析出是因为室温下,氯酸钾在水中的溶解度明显小于其它晶体
28.CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101kPa下,已知该反应消耗1 mol CuCl(s),放热44.4 kJ,根据题意可得该反应的热化学方程式是4CuCl(s) + O2(g) = 2CuCl2(s) + 2CuO(s) ΔH=—177.6kJ/mol。
考点:考查原子核外电子的排布、物质内的化学键的类型的判断、物质电子式的书写、物质的保存、元素非金属性强弱比较、氧化还原反应方程式的配平及热化学方程式的书写的知识。


科目:高中化学 来源:2014-2015学年上海市闸北区高三上学期期末化学试卷(解析版) 题型:选择题
已知钡的某种同位素是 ,由学过的知识无法推断出的信息是
,由学过的知识无法推断出的信息是
A.钡元素的相对原子质量 B.钡元素在周期表中的位置
C.钡原子的核电荷数 D.钡原子的核外电子排布
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市嘉定区高三一模化学试卷(解析版) 题型:填空题
探究外界条件对化学反应速率的影响常用到该反应
已知:Na2S2O3+H2SO4→Na2SO4+S↓+SO2+H2O
针对上述反应涉及到的元素或物质及性质回答有关问题:
23.硫元素的化合价由高到低顺序为:______________________________
涉及元素的简单离子半径由小到大顺序为:______________________________;
24.氧原子的最外层电子排布轨道表示式:______________________________;
列举2个能说明氧、硫两种元素非金属性强弱事实:______________________________;
25.预测镁在二氧化硫中燃烧的现象:________________________________________
产物除氧化镁、硫磺外还可能有 生成。
26.下面是某同学是根据该反应实验数据绘制的图表
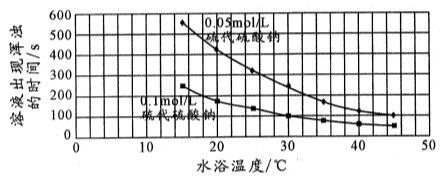
该同学得出的结论是:
_________________________________________________________________________________。
27.将SO2通入BaCl2溶液至饱和,未见沉淀生成,继续滴加一定量的氨水后,生成BaSO3沉淀,用电离平衡原理解释上述现象。
_________________________________________________________________________________。
若继续通入另两种气体如Cl2 和H2S也会产生沉淀,请用化学方程式表示生成沉淀的原理。
_________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市嘉定区高三一模化学试卷(解析版) 题型:选择题
根据原子结构及元素周期律的知识,下列推断正确的是
A.同主族元素含氧酸的酸性随核电荷数的增加而减弱
B.核外电子排布相同的微粒化学性质相同
C.Cl-、S2-、Ca2+、K+半径逐渐减小
D.还原性强弱: F- < Cl- < I-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市虹口区高三上学期期末考试化学试卷(解析版) 题型:填空题
(本题共12分)
M(结构简式: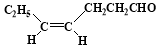 )不溶于水,是一种昂贵的食用香料,也是重要的医药中间体。M的一条合成路线如下(部分反应试剂和条件略去),且D与M互为同分异构体。
)不溶于水,是一种昂贵的食用香料,也是重要的医药中间体。M的一条合成路线如下(部分反应试剂和条件略去),且D与M互为同分异构体。
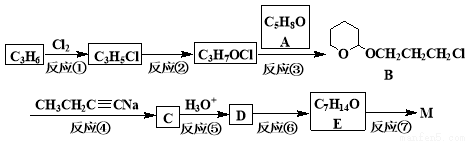
已知︰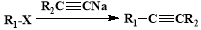
完成下列填空:
50.写出反应类型。 反应①_____________ 反应⑦_____________
51.写出结构简式。 A_________________ D__________________
52.写出检验E已完全转化为M的方法_______________________________。
53.写出一种满足下列条件C的同分异构体的结构简式(不考虑立体异构)___________。
i.能发生银镜反应
ii.无环状结构
iii.分子中有2种化学环境不同的氢原子
54.完成以C3H6为有机原料制备丙酸(CH3CH2COOH)(其他无机原料任选)的合成路线。
(合成路线的常用表示方法为: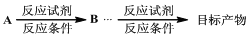 )
)
55.反应③的目的是_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市虹口区高三上学期期末考试化学试卷(解析版) 题型:选择题
下列除杂(括号内为少量杂质)所用方法合理的是
A.FeCl3溶液(CuCl2):铁粉,过滤
B.NaBr溶液(NaI):溴水,萃取分液
C.苯(苯酚):NaOH溶液,蒸馏
D.氯化氢(氯气):饱和食盐水,洗气
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市长宁区高三上学期教学质量检测化学试卷(解析版) 题型:填空题
(本题共12分)磷单质及其化合物在工业生产中有着广泛的应用。白磷可用于制备高纯度的磷酸(磷酸结构式为 ),次磷酸钠(NaH2PO2)可用于化学镀镍等等。
),次磷酸钠(NaH2PO2)可用于化学镀镍等等。
完成下列填空:
23.NaH2PO2中涉及到四种元素,它们的原子半径由小到大的顺序为____________。
24.写出与磷同周期的主族元素中,离子半径最小的元素,其最高价氧化物对应水化物的电离方程式______。
25.磷酸二氢钠主要用于制革、处理锅炉水及在食品工业、发酵工业中作缓冲剂。其水溶液呈酸性的原因是_______________________________________________________。(请用文字描述)
26.已知磷酸分子中的三个氢原子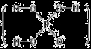 都可以跟重水分子(D2O)中的D原子发生氢交换。 又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能跟D2O发生氢交换。由此可推断出H3PO2的分子结构是
都可以跟重水分子(D2O)中的D原子发生氢交换。 又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能跟D2O发生氢交换。由此可推断出H3PO2的分子结构是

27.次磷酸钠(NaH2PO2)可用于化学镀镍。化学镀镍的溶液中含有Ni2+和H2PO2-,在一定条件下能发生如下反应:__Ni2++__H2PO2-+ →__Ni + ___H2PO3-+_____。请完成并配平上述反应离子方程式。该反应的还原产物是__________,反应中转移1摩尔电子时,理论上产生金属镍______克。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省等四校高三第二次联考化学试卷(解析版) 题型:填空题
(10分)有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y单质晶体熔点高硬度大。试回答下列问题:
(1)五种元素中原子半径最大的元素是__________(写元素符号)
(2)X与M两元素以原子个数1:1形成的化合物的电子式为____________________
(3)写出由YM2制取Y单质的化学方程式____________________
(4)化合物Z 2 W 2遇水剧烈反应,产生黄色沉淀和刺激性气味的气体,其反应的化学方程式为____________
(5)W、M两元素形成的单质和化合物常用来杀菌消毒,试举例__________(写化学式,任写两种)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com