
| 选项 | 实验事实 | 理论解释 |
| A | H2S的沸点比H2O的高 | H2S的范德华力大于H2O的范德华力 |
| B | 白磷为正四面体分子 | 白磷分子中P-P-P的键角是109.5° |
| C | 1体积水可以溶解700体积氨气 | 氨是极性分子且有氢键的影响 |
| D | 键的极性:H-O>N-H | 非金属性差异越大,键的极性越小 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、水分子间存在氢键;
B、白磷分子为正四面体结构,两个P-P间的键角为60°;
C、氨气和水分子都是极性分子,且二者都存在氢键;
D、非金属性差异越大,键的极性越大.
解答 解:A、水分子间存在氢键,而是水的沸点高于硫化氢,故A错误;
B、白磷分子为正四面体结构,两个P-P间的键角为60°,而不是109.5°,故B错误;
C、氨气和水分子中都含有氢键,二者都是极性分子,并且氨气能和水分子之间形成氢键,则氨气极易溶于水,故C正确;
D、非金属性差异越大,键的极性越大,而不是越小,故D错误;
故选C.
点评 本题考查较为综合,涉及电解质、分子构型、氢键等知识,题目难度中等,C项为易错点,要求学生加强对氢键的学习和理解.


科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 稀硫酸与氢氧化钡溶液反应:SO${\;}_{4}^{2-}$+Ba2+═BaSO4↓ | |
| C. | 用氨水溶液氯化银沉淀:Ag++2NH3•H2O═[Ag(NH3)2]++2H20 | |
| D. | Fe(OH)3 溶于过量的HI溶液:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
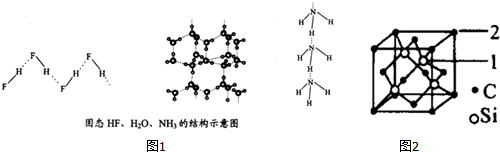
| 物质 | 氢键X-H…Y | 键能KJ•mol-1 |
| (HF)n | F-H…F | 28.1 |
| 冰 | O-H…O | 18.8 |
| (NH3)n | N-H…N | 5.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
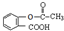 )是应用最广的解热镇痛药.通过乙二醇把阿斯匹林连接在高聚物E上,可制成缓释长效阿斯匹林.其合成过程如下:
)是应用最广的解热镇痛药.通过乙二醇把阿斯匹林连接在高聚物E上,可制成缓释长效阿斯匹林.其合成过程如下: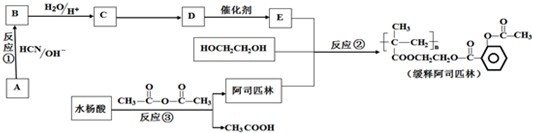
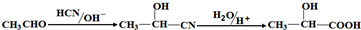
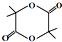 ;;聚合物
;;聚合物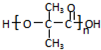 .
.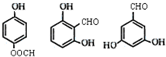 任意2种.
任意2种.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2溶于水形成碳酸,SiO2难溶于水 | |
| B. | CO2通入Na2SiO3稀溶液中,生成白色胶状沉淀硅酸 | |
| C. | 高温下SiO2与碳酸盐反应生成CO2 | |
| D. | HCl通入可溶性碳酸盐溶液中放出气体,氯化氢通入可溶性硅酸盐溶液中生成沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沱牌舍得酒标签注有“酒精度53%Vol”字样,它表示100g该白酒中含有53g,酒精 | |
| B. | 食盐可作调味剂,也可作食品防腐剂 | |
| C. | 碘是人体必须微量元素,所以要多吃富含高碘酸的食物 | |
| D. | “温室效应”、“酸雨”的形成都与氮氧化合物有关 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com