
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| X(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| X(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
分析 (1)当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化;
(2)根据表中数据知,反应达到平衡状态时,HI的物质的量分数是0.784,碘和氢气的物质的量分数相等为0.108,其化学平衡常数K=$\frac{c({H}_{2}).c({I}_{2})}{{c}^{2}(HI)}$;
(3)根据化学平衡常数公式确定k逆、K、k正的关系;根据v正=k正x2(HI)计算正反应速率.
解答 解:(1)A.碘化氢的生成速率和分解速率相等,说明该反应达到平衡状态,故正确;
B.无论反应是否达到平衡状态,都存在单位时间内1molH-H键生成同时有2molH-I断开,所以不能据此判断平衡状态,故错误;
C.恒容的容器中,无论反应是否达到平衡状态,气体密度始终不变,所以不能据此判断平衡状态,
故错误;
D.反应前后气体计量数之和不变,所以恒容的容器中,压强始终保持不变,不能据此判断平衡状态,故错误;
E.无论反应是否达到平衡状态,c(H2)和c(I2)的浓度始终相等,所以不能据此判断平衡状态,故错误;
F.反应前后气体的计量数之和不变,气体质量不变,所以气体的平均摩尔质量始终不变,所以不能据此判断平衡状态,故错误;
G.容器内气体颜色保持不变,说明正逆反应速率相等,该反应达到平衡状态,故正确;
故选AG;
(2)根据表中数据知,反应达到平衡状态时,HI的物质的量分数是0.784,碘和氢气的物质的量分数相等为0.108,其化学平衡常数K=$\frac{c({H}_{2}).c({I}_{2})}{{c}^{2}(HI)}$=$\frac{0.10{8}^{2}}{0.78{4}^{2}}$,
故答案为:$\frac{0.10{8}^{2}}{0.78{4}^{2}}$;
(3)该反应达到平衡状态时正逆反应速率相等,v正=k正x2(HI)=v逆=k逆x(H2)x(I2),则k逆=k正.$\frac{x(HI)^{2}}{x({H}_{2}).x({I}_{2})}$=$\frac{{k}_{正}}{K}$,若k正=0.0027min-1,在t=40min时,v正=0.0027min-1×0.852=1.95×10-3min-1,故答案为:$\frac{{k}_{正}}{K}$;1.95×10-3.
点评 本题考查化学平衡状态判断、化学平衡常数有关计算等知识点,侧重考查学生分析判断能力,易错点是平衡状态判断,注意:只有反应前后改变的物理量才能作为平衡状态判断依据,难点是(3)题计算.


 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:多选题
| A. | 中和热(△H)的测定中,若使用简易装置时在大小烧杯之间没有垫碎泡沫塑料(或纸条) | |
| B. | 用标准盐酸滴定氢氧化钠溶液,酸式滴定管洗净后,没有用标准盐酸润洗,所测出的碱液的浓度值 | |
| C. | 食醋总酸含量测定实验中,用移液管移取食醋体积时视线俯视标准线移液 | |
| D. | 在镀锌铁皮的锌镀层厚度的测定中,锌在酸中溶解后没有及时取出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
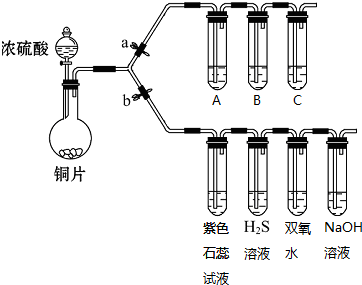
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铁屑、溴水、苯混合制溴苯 | |
| B. | 在苯中滴入浓硝酸制硝基苯 | |
| C. | 用乙醇和乙酸混合共热制取乙酸乙酯 | |
| D. | 将铜丝在酒精灯加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
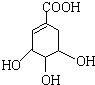
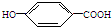 ),其反应类型是消去反应.
),其反应类型是消去反应.
 +CH3CH218OH$?_{△}^{浓硫酸}$
+CH3CH218OH$?_{△}^{浓硫酸}$ +H2O.
+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com