
分析 (1)根据方程式可知恰好反应时H2S、SO2的物质的量之比;
(2)若反应后的压强为反应前的0.25倍(恒温恒容),则剩余气体物质的量为(a+b)mol×0.25=0.25(a+b)mol,可能剩余H2S,也可能剩余SO2,结合方程式计算解答;
(3)发生反应:2Na2S+Na2SO3+3H2SO4=3S↓+2H2O+3Na2SO4,
(i)只有沉淀产生,Na2S、Na2SO3恰好反应;
(ii)除了沉淀还有硫化氢剩余,Na2S有剩余,再与硫酸反应生成硫化氢;
(iii)除了沉淀还有SO2产生,Na2SO3有剩余,再与硫酸反应生成二氧化硫.
解答 解:(1)由2H2S+SO2=3S↓+2H2O,可知恰好反应时H2S、SO2的物质的量之比a:b=2:1,
故答案为:2:1;
(2)若反应后的压强为反应前的0.25倍(恒温恒容),则剩余气体物质的量为(a+b)mol×0.25=0.25(a+b)mol,参加反应气体总物质的量为0.75(a+b)mol,由 2H2S+SO2=3S↓+2H2O,可知反应硫化氢为0.75(a+b)mol×$\frac{2}{3}$=0.5(a+b)mol,反应的二氧化硫为0.75(a+b)mol×$\frac{1}{3}$=0.25(a+b)mol,
若剩余H2S,则a:b=[0.25(a+b)mol+0.5(a+b)mol]:0.25(a+b)mol=3:1,
若剩余SO2,则a:b=0.5(a+b)mol:[0.25(a+b)mol+0.25(a+b)mol]=1:1,
故答案为:3:1或1:1;
(3)发生反应:2Na2S+Na2SO3+3H2SO4=3S↓+2H2O+3Na2SO4,
(i)只有沉淀产生,Na2S、Na2SO3恰好反应,则a:b=2:1,故答案为:2:1;
(ii)除了沉淀还有硫化氢剩余,Na2S有剩余,再与硫酸反应生成硫化氢,则a:b>2:1,故答案为:大于2:1;
(iii)除了沉淀还有SO2产生,Na2SO3有剩余,再与硫酸反应生成二氧化硫,则a:b<2:1,故答案为:小于2:1.
点评 本题考查混合物有关计算,涉及讨论型过量计算,难度不大,注意根据方程式计算解答.


科目:高中化学 来源: 题型:选择题
| A. | 甲酸钠溶液和盐酸反应:HCOO-+H+═HCOOH | |
| B. | 硫化钠的第一步水解:S2-+2H2O?H2S+2OH- | |
| C. | 醋酸钡溶液和硫酸反应:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸氢钠的水解:HCO3-+H2O═H3O++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0mol/LKNO3溶液:H+、Fe2+、SCN-、SO42- | |
| B. | 2.0mol/LNaAlO2溶液:Cl-、HCO3-、K+、ClO- | |
| C. | 某澄清透明的溶液:Fe2+、SO42-、Mg2+、Cl- | |
| D. | c(ClO-)=2.0mol/L的溶液:Na+、I-、S2-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 杂质方法 | 除杂方法 | 原理 |
| A | 苯中含苯酚杂质 | 加入浓溴水,过滤 | 苯酚能与溴水反应生成白色沉淀 |
| B | 乙酸乙酯中含乙酸杂质 | 加饱和Na2CO3溶液洗涤,分液 | 乙酸乙酯在饱和Na2CO3溶液中的溶解度小且乙酸与Na2CO3反应 |
| C | 除去溴苯中的苯 | 蒸馏 | 苯的沸点比溴苯高 |
| D | 乙醇中含乙酸杂质 | 加入饱和Na2CO3溶液洗涤,分液 | 乙酸能与Na2CO3反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水中加入少量固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+cOH-) | |
| B. | pH=9的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+) | |
| D. | 0.1mol•L-1CH3COOH溶液与0.05mol•L-1NaOH溶液等体积混合:2c(H+)+c((CH3COOH)=c(CH3COO-)+2c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )是一种治疗心脏病的药物,可由甲基丙烯、丙烯和
)是一种治疗心脏病的药物,可由甲基丙烯、丙烯和 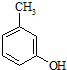 为原料制取.
为原料制取.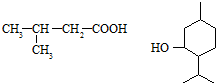 .
.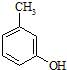 的名称3-甲基苯酚,其属于芳香族化合物的同分异构有4种(不含
的名称3-甲基苯酚,其属于芳香族化合物的同分异构有4种(不含 ).
). +CH3-CH=CH2$\stackrel{AlCl_{3}}{→}$
+CH3-CH=CH2$\stackrel{AlCl_{3}}{→}$ 反应类型属于加成反应.有机反应中通常副反应较多,实际生产中发现生成
反应类型属于加成反应.有机反应中通常副反应较多,实际生产中发现生成 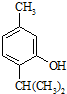 的量远大于生成
的量远大于生成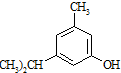 的量,试分析其原因:羟基使得苯环的邻对位氢原子易于取代.
的量,试分析其原因:羟基使得苯环的邻对位氢原子易于取代.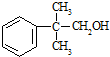 的合成线路:(合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物 )
的合成线路:(合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物 ) .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com