
分析 (1)①锌与杂质铜离子发生氧化还原反应,生成铜与锌构成原电池;
②阴极是氧化性强的氢离子发生还原反应生成氢气;
(2)由反应4Li+2SOCl2═4LiCl+S+SO2分析反应的化合价变化,可得Li为还原剂,SOCl2为氧化剂,负极材料为Li(还原剂),发生氧化反应,电极反应式为Li-e-═Li+,正极发生还原反应,电极方程式为:2SOCl2+4e-═4Cl-+S+SO2,据此分析;
(3)阴极氧气发生还原反应生成氧负离子,结合二氧化碳,生成碳酸根离子,电极反应式为:O2+2CO2+4e-=2CO32-;
(4)电解池中阳极上氯离子发生氧化反应,阳极的电极反应式为2Cl--2e-=Cl2↑,在阴极水电离的氢离子放电生成氢气,产生氢氧根离子,使溶液呈碱性.
解答 解:(1)①锌与杂质铜离子发生氧化还原反应,生成铜与锌构成原电池,所以反应速率加快,故答案为:锌与还原出来的Cu构成铜锌原电池而加快锌的腐蚀;
②阴极是氧化性强的氢离子发生还原反应生成氢气,所以电极反应式为:2H++2e=H2↑,故答案为:2H++2e=H2↑;
(2)由反应4Li+2SOCl2═4LiCl+S+SO2分析反应的化合价变化,可得Li为还原剂,SOCl2为氧化剂,负极材料为Li(还原剂),发生氧化反应,电极反应式为Li-e-═Li+,正极发生还原反应,电极方程式为:2SOCl2+4e-═4Cl-+S+SO2,故答案为:锂; 2SOCl2+4e-=4Cl-+S+SO2;
(3)阴极氧气发生还原反应生成氧负离子,结合二氧化碳,生成碳酸根离子,电极反应式为:O2+2CO2+4e-=2CO32-,故答案为:O2+2CO2+4e-=2CO32-;
(4)电解池中阳极上氯离子发生氧化反应,阳极的电极反应式为2Cl--2e-=Cl2↑,在阴极水电离的氢离子放电生成氢气,产生氢氧根离子,使溶液呈碱性,所以观察到有无色气体生成,同时溶液变红色,故答案为:2Cl--2e-=Cl2↑;有无色气体生成,同时溶液变红色.
点评 本题以燃料电池为载体考查原电池原理,侧重考查学生书写电极反应式,注意结合电解质书写电极反应式,为学习难点.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 蔗糖与纤维素均属于高分子化合物 | |
| B. | 不同的油脂发生皂化反应,至少有一种产物相同 | |
| C. | 淀粉在稀硫酸作用下充分加热后,所得溶液与少量新制Cu(OH)2共热未见红色沉淀,说明淀粉未发生水解 | |
| D. | 蛋白质溶液中加入酒精后会发生盐析而失去生理活性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
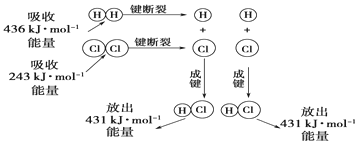
| A. | -332kJ | B. | -118kJ | C. | +130kJ•mol-1 | D. | +350kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
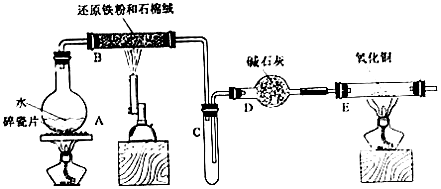
| 步骤 | 操作 | 甲组现象 | 乙组现象 | |
| 1 | 取黑色粉末加入稀盐酸 | 洛解,无气泡 | 溶解,无气泡 | |
| 2 | 取少骤1中溶液,滴加酸性KMnO4溶液 | 紫色褪去 | 紫色褪去 | |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 | |
| 4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去乙烷中少量的乙烯:气体通过盛酸性高锰酸钾溶液的洗气瓶 | |
| B. | 除去乙酸乙酯中少量的乙酸:用氢氧化钠溶液洗涤、分液、干燥、蒸馏 | |
| C. | 除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶 | |
| D. | 除去乙醇中少量的乙酸:加足量生石灰、蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
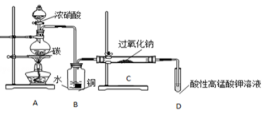 亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量.某兴趣小组进行下面实验探究,查阅资料知道:
亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量.某兴趣小组进行下面实验探究,查阅资料知道:| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com