
| A、上述反应中,CO是还原产物 |
| B、AlN中氮元素的化合价为+3 |
| C、上述反应中,每生成1molAlN转移的电子数为3NA |
| D、AlN的摩尔质量为41 |


科目:高中化学 来源: 题型:
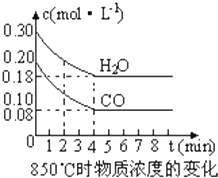 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 新型纳米材料氧缺位铁酸盐(MFe2Ox 3<x<4,M=Mn、Co、Zn或Ni,在该盐中均显+2价)由铁酸盐(MFe2O4)经高温与氢气反应制得,常温下,它能使工业废气中的酸性氧化物(SO2、NO2等)转化为其单质除去,转化流程如图.关于此转化过程的叙述不正确的是( )
新型纳米材料氧缺位铁酸盐(MFe2Ox 3<x<4,M=Mn、Co、Zn或Ni,在该盐中均显+2价)由铁酸盐(MFe2O4)经高温与氢气反应制得,常温下,它能使工业废气中的酸性氧化物(SO2、NO2等)转化为其单质除去,转化流程如图.关于此转化过程的叙述不正确的是( )| A、MFe2O4在与H2的反应中表现了氧化性 |
| B、MFe2O4与MFe2Ox的相互转化反应均属于氧化还原反应 |
| C、MFe2Ox与SO2反应中MFe2Ox被还原 |
| D、若4 mol MFe2Ox与1 mol SO2恰好完全反应,则MFe2Ox中x的值为3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在常温常压下,11.2 L N2含有的分子数为0.5 NA |
| B、在常温常压下,1mol He含有的原子数为2 NA |
| C、71g Cl2 所含原子数为2 NA |
| D、23g Na在化学反应中失去的电子数目为10 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有①②④ | B、①②③④ |
| C、只有①③④ | D、只有①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
A、 |
B、 |
C、 |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、黄色变浅 | B、红色变深 |
| C、褪为无色 | D、黄色变深 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com