
【题目】下列说法不正确的是( )
A.强酸、强碱、重金属盐等可使蛋白质变性
B.用新制氢氧化铜悬浊液(必要时可加热)能鉴别甲酸、乙醇、乙醛
C.乙酸乙酯中混有的乙酸,可加入足量的饱和![]() 溶液,经分液除去
溶液,经分液除去
D.向苯和苯酚的混合液中加入浓溴水,充分反应后过滤,可除去苯中少量的苯酚
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】洛匹那韦(Lopinavir)是抗艾滋病毒常用药,在“众志成城战疫情”中,洛匹那韦,利托那韦合剂被用于抗新型冠状病毒(2019-nCoV)。洛匹那韦的合成路线可设计如图:

回答下列问题:
(1)A的化学名称是_______;A制备B反应的化学方程式为_________(注明反应条件)。
(2)D生成E的反应类型为_____;F中能与氢气发生加成反应的官能团名称为___。
(3)C的分子式为_____;一定条件下,C能发生缩聚反应,化学方程式为_____。
(4)K2CO3具有碱性,其在制备D的反应中可能的作用是______。
(5)X是C的同分异构体,写出一种符合下列条件的X的结构简式______。
①含有苯环,且苯环上的取代基数目≤2
②含有硝基
③有四种不同化学环境的氢,个数比为6:2:2:1
(6)已知:CH3COOH![]() CH3COCl,(2,6-二甲基苯氧基)乙酰氯(
CH3COCl,(2,6-二甲基苯氧基)乙酰氯(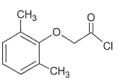 )是由G合成洛匹那韦的原料之一,写出以2,6-二甲基苯酚、ClCH2COOCH2CH3、K2CO3为原料制各该物质的合成路线________(其它无机试剂任选)。
)是由G合成洛匹那韦的原料之一,写出以2,6-二甲基苯酚、ClCH2COOCH2CH3、K2CO3为原料制各该物质的合成路线________(其它无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香酸是分子中羧基与苯环直接相连的一类有机物,通常用芳香烃的氧化来制备。反应原理如下:
![]() +2KMnO4
+2KMnO4![]() +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O
![]() +HCl
+HCl![]() +KCl
+KCl
反应试剂、产物的物理常数:
名称 | 相对分子质量 | 性状 | 熔点(℃) | 沸点(℃) | 密度(g/cm3) | 水中的溶解性 |
甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 |
苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 |
主要实验装置和流程如图:

实验方法:一定量的甲苯和KMnO4溶液加入图1装置中,在90℃时,反应一段时间后,停止反应,按如图流程分离出苯甲酸并回收未反应的甲苯。

(1)白色固体B中主要成分的分子式为______,操作Ⅱ为______。
(2)下列关于仪器的组装或者使用正确的是______。
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌器下端不能与三颈烧瓶底、温度计等接触
C.如图回流搅拌装置应采用直接加热的方法
D.冷凝管中水的流向是上进下出
(3)除去残留在苯甲酸中的甲苯应先加入______,分液,然后再向水层中加入______,抽滤,洗涤,干燥即可得到苯甲酸。
(4)纯度测定:称取2.440g产品,配成100mL溶液,取其中25.00mL溶液,行滴定,消耗KOH物质的量为4.5×10-3mol。产品中苯甲酸质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(含氧化铝、氧化铁)制取铝的过程如下:

请回答下列问题:
(1)沉淀C的化学式为____,C与金属Al可以在高温下发生反应,可用于焊接铁轨。则该反应的化学方程式为_________。
(2)操作Ⅰ、操作Ⅱ 和操作Ⅲ 都是____(填操作名称),实验室要洗涤Al(OH)3沉淀,洗涤方法是____________。
(3)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有______(填化学式)。用此法制取铝的副产品是______(填化学式)。
(4)金属铝的生产是以Al2O3为原料,在熔融状态下进行电解:![]() ,电解熔融的氧化铝,若得到标准状况下11.2 L O2,则同时生成____g铝。
,电解熔融的氧化铝,若得到标准状况下11.2 L O2,则同时生成____g铝。
下列有关此工艺的说法合理的是______
A.冰品石(Na3AlF6)的作用是降低Al2O3的熔化温度
B.电解生成的金属铝是在熔融液的上层
C.电解过程中的电极材料可以为金属材料
D.铝是高耗能产品,废旧铝材的回收后制成氧化铝比较合理
(5)若铝土矿中还含有二氧化硅,此生产过程中得到的氧化铝将混有杂质:___(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅冶炼的大致过程如下:
①富集:将方铅矿(PbS)进行浮选;
②焙烧:2PbS+3O2![]() 2PbO+2SO2;
2PbO+2SO2;
③制粗铅:PbO+C![]() Pb+CO, PbO+CO
Pb+CO, PbO+CO![]() Pb+CO2。
Pb+CO2。
下列说法正确的是( )
A.浮选法富集方铅矿的过程发生的是物理变化
B.在方铅矿的焙烧反应中,PbS是还原剂,发生还原反应
C.过程②中,制取1 mol PbO共转移2 mol电子
D.将1 mol PbS冶炼成Pb理论上至少需要6 g碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氯碱工业中,离子交换膜法电解饱和食盐水示意图如下,下列说法不正确的是( )

离子交换膜
A.电极A为阳极,发生氧化反应生成氯气
B.离子交换膜为阳离子交换膜
C.饱和NaCl从a处进,NaOH溶液从d处出
D.OH-迁移的数量等于导线上通过电子的数量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向![]() 盐酸中滴加
盐酸中滴加![]() 溶液,溶液的pH随
溶液,溶液的pH随![]() 溶液体积的变化如图。已知
溶液体积的变化如图。已知![]() 。下列说法不正确的是( )
。下列说法不正确的是( )
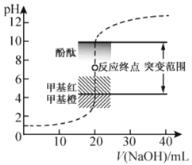
A.![]() 与盐酸恰好完全反应时,
与盐酸恰好完全反应时,![]()
B.选择变色范围在pH突变范围内的指示剂,可减小实验误差
C.选择甲基红指示反应终点,误差比甲基橙的大
D.![]() 时,
时,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氯气和氢氧化钠的反应条件不同,产物也不同,在实验室里可用如图所示装置制取氯酸钠次氯酸钠和探究氯水的性质。
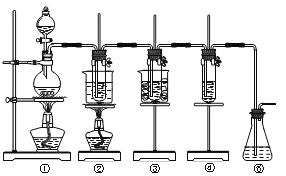
图中:①为氯气发生装置;②的试管里盛有15mL 30% NaOH溶液,并置于热水浴中;
③的试管里盛有15mL 8%NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过_________(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有_________(填写下列编号字母)的净化装置。
A.碱石灰 | B.饱和食盐水 | C.浓硫酸 | D.饱和碳酸氢钠溶液 |
(2)比较制取氯酸钠和次氯酸钠的条件,指出二者的差异:______________________。
(3)本实验中制取次氯酸钠的离子方程式是__________________________________。
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
实验现象 | 原因 |
溶液最初从紫色逐渐变为_______色 | 氯气与水反应生成的H+使石蕊变色 |
随后溶液逐渐变为无色 | _________________ |
然后溶液从无色逐渐变为_______色 | __________________________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列卤代烃在KOH醇溶液中加热不发生消去反应的是( )
①![]() ②
②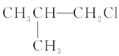 ③(CH3)3CCH2Cl ④CHCl2-CHBr2 ⑤
③(CH3)3CCH2Cl ④CHCl2-CHBr2 ⑤![]() ⑥CH3Cl
⑥CH3Cl
A.①③⑥B.②③⑤C.全部D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com