
| A.难溶电解质在水中存在沉淀溶解平衡,且是一种动态平衡 |
| B.Ksp只与难溶电解质的性质和温度有关,而与沉淀的量和溶液中离子的浓度无关 |
| C.Ksp反映了物质在水中的溶解能力,可直接根据Ksp的数值大小比较电解质在水中的溶解能力大小 |
| D.可以通过浓度商(Qc)和Ksp的相对大小,来判断沉淀溶解平衡的移动方向 |
 考前必练系列答案
考前必练系列答案科目:高中化学 来源:不详 题型:判断题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
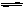 Pb2+(aq)+2I-(aq),加入KI溶液,下列说法正确的是 ( )
Pb2+(aq)+2I-(aq),加入KI溶液,下列说法正确的是 ( )| A.溶液中Pb2+和I-浓度都增大。 | B.溶度积常数Ksp增大 |
| C.沉淀溶解平衡向左移动 | D.浓度商Qc增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
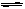 Pb2+(aq)+2I-(aq),下列描述正确的是 ( )
Pb2+(aq)+2I-(aq),下列描述正确的是 ( )| A.说明PbI2难电离 | B.说明PbI2难溶解 |
| C.这是电离方程式 | D.这是沉淀溶解平衡表达式 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1.8×10-9mol?L-1 | B.1.8×10-10mol?L-1 |
| C.5.9×10-10mol?L-1 | D.5.9×10-9mol?L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:多选题
| A.对于平衡Ca(OH)2(s)?Ca2+(aq)+2OH-(aq),加入NH4Cl溶液,可使Ca(OH)2减小 |
| B.在AgBr饱和溶液中加入AgNO3溶液,达到平衡时,溶液中Ksp(AgBr)降低 |
| C.温度一定时,当溶液中c(Ag+)和c(Cl-)的乘积等于Ksp值时,此溶液为AgCl的饱和溶液 |
| D.把固体AgCl加入较浓的KI溶液中振荡,部分AgCl转化为AgI,其原因是AgI比AgCl稳定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 BaCO
BaCO 3(s)+SO42-(aq)(平衡常数K=0.042)
3(s)+SO42-(aq)(平衡常数K=0.042)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com