
 2HI(g)
2HI(g)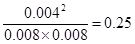


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源:不详 题型:填空题
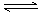 a Z(g) + W(g) △H =-QkJ·mol-1 (Q>0)
a Z(g) + W(g) △H =-QkJ·mol-1 (Q>0)| A.2 molX.1mol Y.1molAr | B.a molZ.1mol W |
| C.1 molX.0.5mol Y.0.5a molZ.0.5 mol W | D.4 molX.2mol Y |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NO2(g)(正反应放热)中NO的最大转化率与温度的关系。图上标有A、B、C、D、E五点,其中表示未达到平衡状态,且v正>v逆的点是( )
2NO2(g)(正反应放热)中NO的最大转化率与温度的关系。图上标有A、B、C、D、E五点,其中表示未达到平衡状态,且v正>v逆的点是( )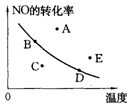
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 2SO3(g) △H<0 ,温度一定,体积为3L的密闭容器中,投入2 mol SO2和1 molO2, 2min反应达平衡时,容器中有1.2 mol SO3,放出热量117.6 kJ,试计算:
2SO3(g) △H<0 ,温度一定,体积为3L的密闭容器中,投入2 mol SO2和1 molO2, 2min反应达平衡时,容器中有1.2 mol SO3,放出热量117.6 kJ,试计算:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
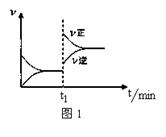
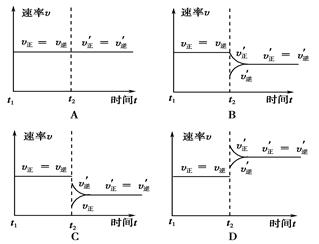
A.2SO2(g)+O2(g)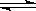 2SO3(g) ΔH<0,t1时刻升高温度 2SO3(g) ΔH<0,t1时刻升高温度 |
B.4NH3(g)+5O2(g)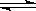 4NO(g)+6H2O(g) ΔH<0,t1时刻增大O2浓度 4NO(g)+6H2O(g) ΔH<0,t1时刻增大O2浓度 |
C.H2O(g)+CO(g)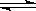 H2(g)+CO2(g) ΔH>0, t1时刻增大压强 H2(g)+CO2(g) ΔH>0, t1时刻增大压强 |
D.C(s)+H2O(g)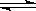 CO(g)+H2(g) ΔH>0,t1时刻升高温度 CO(g)+H2(g) ΔH>0,t1时刻升高温度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.只有⑴ | B.⑴⑷ | C.⑵⑶⑷ | D.⑴⑵ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:| T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3(g),已知起始时c(SO2)="0.4" mol·L-1,c(O2)=1mol·L-1,经测定该反应在该温度下的平衡常数K=19,当SO2转化率为50%时,该反应将( )
2SO3(g),已知起始时c(SO2)="0.4" mol·L-1,c(O2)=1mol·L-1,经测定该反应在该温度下的平衡常数K=19,当SO2转化率为50%时,该反应将( )| A.向正反应方向进行 | B.向逆反应方向进行 | C.达到平衡状态 | D.无法判断 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g) ΔH<0。向同温、同体积的三个密闭容器中分别充入气体(甲) 2 mol A和1 mol B;(乙) 1 mol A和0.5 molB ;(丙) 2 mol C:恒温、恒容下反应达平衡时,下列关系一定正确的是 ( )
2C(g) ΔH<0。向同温、同体积的三个密闭容器中分别充入气体(甲) 2 mol A和1 mol B;(乙) 1 mol A和0.5 molB ;(丙) 2 mol C:恒温、恒容下反应达平衡时,下列关系一定正确的是 ( )查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com