
分析 常温下,0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合后,发生反应CH3COOH+NaOH=CH3COONa+H2O,得到等浓度的CH3COOH溶液与CH3COONa的混合溶液,溶液中醋酸电离大于醋酸根离子水解溶液显酸性,溶液中存在物料守恒和电荷守恒,据此分析判断.
解答 解:常温下,0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合后,发生反应CH3COOH+NaOH=CH3COONa+H2O,得到等浓度的CH3COOH溶液与CH3COONa的混合溶液,溶液中存在物料守恒c(CH3COO-)+c(CH3COOH)=2c(Na+)=2×$\frac{0.1mol/L}{2}$=0.1mol/L,
溶液中存在电荷守恒:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),物料守恒c(CH3COO-)+c(CH3COOH)=2c(Na+),代入计算得到:2c(OH-)+c(CH3COO-)=c(CH3COOH)+2c(H+),所以得到:c(H+)<c(CH3COO-)-c(CH3COOH)+2c(OH-),
故答案为:0.1;<.
点评 本题考查酸碱混合溶液中离子浓度大小的比较,明确酸碱混合后溶液中的溶质及量的关系是解答本题的关键,并利用电离、水解、电荷守恒、物料守恒等知识来解答,题目难度中等.


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | Li、Be、B原子最外层电子数依次升高 | |
| B. | P、S、Cl元素最高正化合价依次升高 | |
| C. | B、C、N、O、F原 子半径依次升高 | |
| D. | Li、Na、K的原子半径依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5mol/L | B. | 3mol/L | C. | 2mol/L | D. | 7mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应速度 vA=2mol/(L•min)逆反应速度vB=2 mol/(L•min) | |
| B. | 正反应速度 vA=2mol/(L•min)逆反应速度vC=2 mol/(L•min) | |
| C. | 正反应速度 vA=1mol/(L•min)逆反应速度vB=1.5 mol/(L•min) | |
| D. | 正反应速度 vA=1mol/(L•min)逆反应速度vC=1.5mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、H+、Cl- SO42- | B. | Na+、K+、Ba2+、HCO3- | ||
| C. | Na+ Cl- NO3- K+ | D. | K+ Na+ Cl- SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

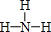 .②的简单气态氢化物的电子式为
.②的简单气态氢化物的电子式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 符号为${\;}_8^{18}O$的原子常用于文物年代的测定 | |
| B. | CO2分子比例模型: | |
| C. | H2O2的电子式: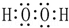 | |
| D. | 结构简式为CH2CH2的分子可发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应放出197 kJ 的热量 | |
| B. | 生成SO3为2 mol | |
| C. | SO2和SO3物质的量之和为2 mol | |
| D. | SO2的物质的量和SO3物质的量一定相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com