
| A. | 标准状况下,22.4 L Cl2与足量水反应,转移的电子数目等于NA | |
| B. | 17 g-18OH所含的电子数目为9NA | |
| C. | 16 g N2 H4中含有的非极性共价键数目为0.5NA | |
| D. | 常温时,1 L pH=12的 Ba(OH)2溶液中含OH一的数目为2×10-2NA |
分析 A、氯气和水的反应为可逆反应;
B、求出-18OH的物质的量,然后根据氢氧根中含10个电子来分析;
C、求出肼的物质的量,然后根据肼中含1条非极性共价键来分析;
D、pH=12的氢氧化钡溶液中氢氧根的浓度为0.01mol/L.
解答 解:A、氯气和水的反应为可逆反应,不能进行彻底,故转移的电子数小于NA个,故A错误;
B、-18OH的摩尔质量为19g/mol,故17g-18OH的物质的量为n=$\frac{17g}{19g/mol}$=$\frac{17}{19}$mol,故氢氧根中含10个电子,故$\frac{17}{19}$mol氢氧根中含$\frac{170}{19}$NA个电子,故B错误;
C、16g肼的物质的量为0.5mol,而肼中含1条非极性共价键,故0.5mol肼中含0.5NA条非极性共价键,故C正确;
D、pH=12的氢氧化钡溶液中氢氧根的浓度为0.01mol/L,故1L溶液中含有的氢氧根的物质的量为0.01mol,个数为0.01NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


科目:高中化学 来源: 题型:选择题
| A. | 用溶解、过滤的方法提纯含有少量 BaSO4 的 BaCO3 | |
| B. | 用过滤的方法除去 NaCl 溶液中含有的少量淀粉胶体 | |
| C. | 用渗析的方法精制 Fe(OH)3 胶体 | |
| D. | 用分液的方法分离水和酒精 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol FeCl3能形成的胶体粒子数为0.1NA | |
| B. | 常温下1L pH=12氨水中含有OH-数目为0.01NA | |
| C. | 0.1mol02完全反应时,转移的电子数为0.4NA | |
| D. | 12克碳单质中所含的共价键数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将氟气通入水中:F2+H2O═H++F++HFO | |
| B. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═2Fe3++Fe2++4H2O | |
| C. | 硝酸银溶液中滴加过量氨水:Ag++NH3•H2O═AgOH↓+NH4+ | |
| D. | 往KAl(SO4)2溶液中滴入Ba(OH)2溶液至沉淀的物质的量最大Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
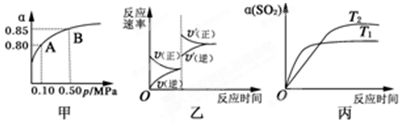
| A. | 由图甲推断,B点SO2的平衡浓度为0.3 mol•L-1 | |
| B. | 由图甲推断,A点对应温度下该反应的平衡常数为800(L•mol-1) | |
| C. | 达平衡后,若增大容器容积,则反应速率变化图象可以用图乙表示 | |
| D. | 压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W和X形成的化合物可能含有非极性共价键 | |
| B. | X和Z形成的化合物常温下为固态 | |
| C. | W、X、Y、Z四种元素组成的化合物的水溶液可能呈酸性 | |
| D. | W、X、Y、Z四种元素两两之间均能形成二元化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②⑤⑥ | C. | ③⑤⑥ | D. | ①③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com