
【题目】X、Y、Z、W为原子序数依次增大的四种短周期主族元素,A、B、C、D、E为上述四种元素中的两种或三种所组成的化合物。已知A的相对分子质量为28,B分子中含有18个电子,五种化合物间的转化关系如图所示。下列说法错误的是( )
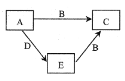
A. X、Y组成化合物的沸点一定比X、Z组成化合物的沸点低
B. Y的最高价氧化物的水化物为弱酸
C. Y、Z组成的分子可能为非极性分子
D. W是所在周期中原子半径最小的元素
【答案】A
【解析】
根据分析A相对原子质量为28的两种或三种元素组成化合物,容易想到一氧化碳和乙烯,而B分子有18个电子的化合物,容易想到氯化氢、硫化氢、磷化氢、硅烷、乙烷、甲醇等,但要根据图中信息要发生反应容易想到A为乙烯,B为氯化氢,C为氯乙烷,D为水,E为甲醇,从而X、Y、Z、W分别为H、C、O、Cl。
A选项,C、H组成化合物为烃,当是固态烃的时候,沸点可能比H、O组成化合物的沸点高,故A错误;
B选项,C的最高价氧化物的水化物是碳酸,它为弱酸,故B正确;
C选项,Y、Z组成的分子二氧化碳为非极性分子,故C正确;
D选项,同周期从左到右半径逐渐减小,因此Cl是第三周期中原子半径最小的元素,故D正确。
综上所述,答案为A。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】砷化镓是继硅之后研究最深人、应用最广泛的半导体材料。回答下列问题:
(1)Ga基态原子核外电子排布式为________________,As基态原子核外有__________个未成对电子。
(2)Ga、As、Se的第一电离能由大到小的顺序是__________,Ga、As、Se的电负性由大到小的顺序是__________________。
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:________,GaF的熔点超过1000℃,可能的原因是__________________________。
(4)二水合草酸镓的结构如图1所示,其中镓原子的配位数为__________,草酸根离子中碳原子的杂化轨道类型为__________。
(5)砷化镓的立方晶胞结构如图2所示,晶胞参数为a=0.565nm,砷化镓晶体的密度为__________g·cm-3(设NA为阿伏加德罗常数的值,列出计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)[Fe2(OH)n(SO4)3-0.5n]m和绿矾FeSO4·7H2O,其过程如图所示,下列说法不正确的是
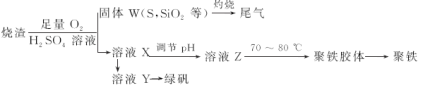
A.炉渣中FeS与硫酸、氧气反应的离子方程式为:4FeS+3O2+12H+=4Fe3++4S+6H2O
B.溶液Z加热到70~80 ℃的目的是促进Fe3+的水解
C.溶液Y经蒸发浓缩、冷却结晶、过滤等步骤可得到绿矾
D.溶液Z的pH影响聚铁中铁的质量分数,若pH偏小导致聚铁中铁的质量分数偏大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述中,不正确的是
A.含20.0g NaOH的稀溶液与稀盐酸完全中和放出28.7 kJ的热量,则表示该反应中和热的热化学方程式为NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1) H=-57.4kJmol-1
B.根据C(石量,s)=C(金刚石,s) H>0 可知石墨比金刚石稳定
C.根据2H2(g)+O2(g)=2H2O(l) H=-483.6 kJmol-l可知H2的燃烧热为241.8kJmol-1
D.由C(s)+O2(g)=CO2(g) H1,C(s)+![]() O2(g)=CO(g) H2 可知 H1>H2
O2(g)=CO(g) H2 可知 H1>H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究黑色固体 X(仅含两种元素)的组成和性质,设计并完成如下实验:
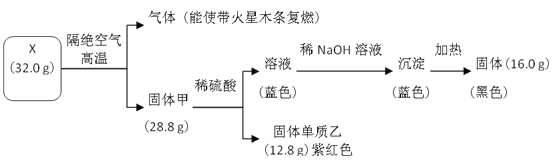
请回答:
(1)X 的化学式是______________。
(2)写出蓝色溶液转化为蓝色沉淀的离子方程式是______________。
(3)写出固体甲与稀硫酸反应的化学方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在绝热恒容密闭容器一定条件下使反应2A(g)+B(s)![]() 3C(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是
3C(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是
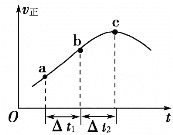
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应ΔH>0
D.Δt1=Δt2时,a~b段消耗A的量小于b~c段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应C(s)+H2O(g)![]() CO(g)+H2(g),ΔH=+206.4 kJ·mol-1,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是
CO(g)+H2(g),ΔH=+206.4 kJ·mol-1,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是
A.升高温度B.增大水蒸气浓度
C.加入大量CD.降低压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
下列判断不正确的是
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=![]() mol/L
mol/L
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1mol·L-1
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-) =c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是![]()
A.可以根据![]() 和AgCl的Ksp的大小比较两者的溶解能力
和AgCl的Ksp的大小比较两者的溶解能力
B.常温下,同浓度的![]() 与NaHS溶液相比,NaHS溶液的pH大
与NaHS溶液相比,NaHS溶液的pH大
C.等物质的量浓度的![]() 溶液和
溶液和![]() 溶液,后者的
溶液,后者的![]() 大
大
D.能使碘化钾淀粉试纸变蓝的溶液中,![]() 、
、![]() 、
、![]() 、
、![]() 等离子可以大量共存
等离子可以大量共存
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com