
| A.-1780kJ/mol | B.-1220 kJ/mol | C.-450 kJ/mol | D.+430 kJ/mol |
科目:高中化学 来源:不详 题型:单选题
 Al2O3+Fe △H=a kJ/mol
Al2O3+Fe △H=a kJ/mol| A.铝热反应在高温下才能发生,因此a>0 |
| B.碳的燃烧热等于110.5 kJ/mol |
| C.稀醋酸与稀NaOH溶液反应生成1 mol水,放出热量小于57.3 kJ |
| D.由条件可知:红磷转化为白磷是放热反应,所以等质量的红磷能量比白磷低 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应物的总能量高于生成物的总能量时,该反应常温下即可发生 |
| B.氢气燃烧热为285.8kJ·mol-1,则有H2(g)+1/2O2(g)=H2O(g) △H=-285.8kJ·mol-1 |
| C.将1molBa(OH)2的稀溶液与稀盐酸完全中和,放出114.6kJ的热量,热化学方程式为:OH-(aq)+H+(aq)=H2O(l) △H =-114.6kJ·mol-1 |
D.2SO2(g)+O2(g)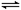 2SO3 (g);△H=-QkJ·mol-1(Q>0),则将2molSO2(g)和足量O2置于一密闭容器中,充分反应后放出的热量一定小于QkJ 2SO3 (g);△H=-QkJ·mol-1(Q>0),则将2molSO2(g)和足量O2置于一密闭容器中,充分反应后放出的热量一定小于QkJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CO2(g) + NaOH(aq) = NaHCO3(aq)△H=" -" (2y-x) kJ·mol-1 |
| B.CO2(g) + NaOH(aq) = NaHCO3(aq)△H=" -" (4x-y) kJ·mol-1 |
| C.CO2(g) + NaOH(aq) = NaHCO3(aq)△H=" -" (2x-y) kJ·mol-1 |
| D.CO2(g) + NaOH(aq) = NaHCO3(aq)△H=" -" (8x-2y) kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.吸热88kJ | B.吸热2.44 kJ | C.放热44kJ | D.吸热44 kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
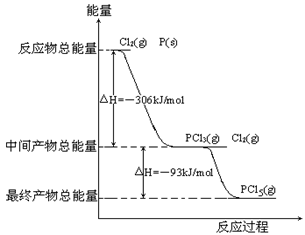
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 化学键 | C-H | C=C | C-C | H-H |
| 键能(kJ/mol) | 414.4 | 615.3 | 347.4 | 435.3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.8 | B.1.3 | C.1.6 | D.3.1? |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol,假设1 mol冰中有2 mol 氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键 |
B.已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为α, 。若加入少量醋酸钠固体,则CH3COOH 。若加入少量醋酸钠固体,则CH3COOH CH3COO-+H+向左移动,α减小,Ka变小 CH3COO-+H+向左移动,α减小,Ka变小 |
| C.实验测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916 kJ/mol、-3747 kJ/mol和-3265 kJ/mol,可以证明在苯分子中不存在独立的碳碳双键 |
D.已知:Fe2O3(s)+3C(石墨) 2Fe(s)+3CO(g),△H=+489.0 kJ/mol。 2Fe(s)+3CO(g),△H=+489.0 kJ/mol。 |
 CO2(g),△H=-283.0 kJ/mol。
CO2(g),△H=-283.0 kJ/mol。 CO2(g),△H=-393.5 kJ/mol。
CO2(g),△H=-393.5 kJ/mol。 2Fe2O3(s),△H=-1641.0 kJ/mol
2Fe2O3(s),△H=-1641.0 kJ/mol查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com