
【题目】亚砷酸(H3AsO3)可用于治疗白血病,在溶液中存在多种微粒形态。向1L0.1mol·L-1 H3AsO3溶液中逐滴加入0.1mol·L-1KOH溶液,各种微粒物质的量分数与溶液的pH关系如下图所示。下列说法正确的是( )
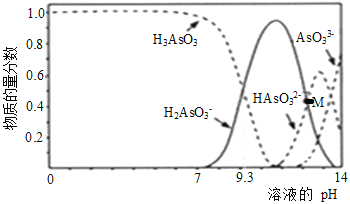
A. H3AsO3的电离常数Ka1的数量级为10-9
B. pH在8.0~10.0时,反应的离子方程式:H3AsO3+OH-=H2AsO3-+H2O
C. M点对应的溶液中:c(H2AsO3-)+c(HAsO32-)+c(AsO33-)+c(H3AsO3)=0.1mol·L-1
D. pH=12时,溶液中:c(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)+c(H3AsO3)>c(H+)+c(K+)
【答案】B
【解析】分析:A项,由H3AsO3和H2AsO3-物质的量分数相等时溶液的pH和电离平衡常数表达式计算Ka1;B项,由图像中含砷微粒的变化确定反应物和生成物,进一步书写离子方程式;C项,根据物料守恒判断;D项,由电荷守恒和图像判断。
详解:A项,H3AsO3的第一步电离方程式为H3AsO3![]() H++H2AsO3-,H3AsO3的Ka1=
H++H2AsO3-,H3AsO3的Ka1=![]() ,根据图像当H3AsO3和H2AsO3-物质的量分数相等时溶液的pH=9.3,溶液中c(H+)=10-9.3mol/L,H3AsO3的Ka1=10-9.3=100.7
,根据图像当H3AsO3和H2AsO3-物质的量分数相等时溶液的pH=9.3,溶液中c(H+)=10-9.3mol/L,H3AsO3的Ka1=10-9.3=100.7![]() 10-10,H3AsO3的Ka1的数量级为10-10,A项错误;B项,pH在8.0~10时,随着KOH的滴入,H3AsO3明显减少,H2AsO3-明显增多,反应的离子方程式为H3AsO3+OH-=H2AsO3-+H2O,B项正确;C项,根据As守恒,M点对应溶液中n(H2AsO3-)+n(HAsO32-)+n(AsO33-)+n(H3AsO3)=0.1mol/L
10-10,H3AsO3的Ka1的数量级为10-10,A项错误;B项,pH在8.0~10时,随着KOH的滴入,H3AsO3明显减少,H2AsO3-明显增多,反应的离子方程式为H3AsO3+OH-=H2AsO3-+H2O,B项正确;C项,根据As守恒,M点对应溶液中n(H2AsO3-)+n(HAsO32-)+n(AsO33-)+n(H3AsO3)=0.1mol/L![]() 1L=0.1mol,由于加入的KOH溶液的体积未知,无法计算含砷微粒的总浓度,C项错误;D项,滴入KOH溶液后,溶液中的电荷守恒为c(OH-)+c(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)=c(H+)+c(K+),根据图像pH=12时溶液中主要含砷微粒为H2AsO3-和HAsO32-,溶液呈碱性,H2AsO3-和HAsO32-的水解程度大于电离程度,而且HAsO32-第二步水解才产生H3AsO3,则溶液中c(OH-)
1L=0.1mol,由于加入的KOH溶液的体积未知,无法计算含砷微粒的总浓度,C项错误;D项,滴入KOH溶液后,溶液中的电荷守恒为c(OH-)+c(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)=c(H+)+c(K+),根据图像pH=12时溶液中主要含砷微粒为H2AsO3-和HAsO32-,溶液呈碱性,H2AsO3-和HAsO32-的水解程度大于电离程度,而且HAsO32-第二步水解才产生H3AsO3,则溶液中c(OH-)![]() c(H3AsO3),c(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)+c(H3AsO3)
c(H3AsO3),c(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)+c(H3AsO3)![]() c(H+)+c(K+),D项错误;答案选B。
c(H+)+c(K+),D项错误;答案选B。


科目:高中化学 来源: 题型:
【题目】(1)指出下图所表示的共价键名称,并列举含有该共价键的一种物质,写出其分子式。
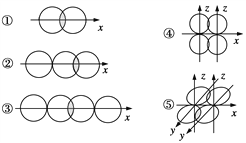
共价键名称 举例
①__________,__________;
②__________,__________;
③__________,__________;
④__________,__________;
⑤__________,__________。
(2)某有机物分子的结构简式为CH2=CHCOOH,该分子中有________个σ键,________个π键,有__________种极性键,__________(填“有”或“没有”)非极性键。
(3)用电子式表示Cl2、NH3、H2S、CO2分子的形成过程________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表前五周期的一部分,X、Y、Z、R、W、J是6种元素的代号。其中J为0族元素。
X | Y | Z | |
R | |||
W | |||
J |
请回答下列问题(除特别说明外,凡涉及用元素回答的问题均用具体元素符号表示):
(1)R原子的电子排布图为__________。
(2)在化合物YZ2中Y的化合价为__________;Y2-与Na+的半径大小为__________。
(3)在X、Y、Z三种元素中,电负性由大到小的顺序是__________;X与Y的第一电离能:X__________Y(填“<”、“>”或“=”),其理由是__________________________________________________________。
【答案】 ![]() +2 O2->Na+ F>O>N > N原子的p轨道为半充满,能量低较稳定,难失电子
+2 O2->Na+ F>O>N > N原子的p轨道为半充满,能量低较稳定,难失电子
【解析】试题分析:X、Y、Z、R、W、J是前五周期的元素,其中J为0族元素,所以X、Y、Z、R、W、J分别是N、O、F、S、Br、Xe;
解析:(1)R是S元素,原子的电子排布图为![]() 。
。
(2)化合物YZ2是OF2,F元素的化合价是-1,所以O元素的化合价为+2;O2-与Na+都有2个电子层,钠的质子数大于氧,所以半径大小为O2->Na+ 。
(3)同周期元素从左到右电负性增大,所以在N、O、F三种元素中,电负性由大到小的顺序是F>O>N;N原子2p能级半充满,能量低较稳定,第一电离能大于相邻的氧元素,N与O的第一电离能:N>O。
【题型】综合题
【结束】
22
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。

试回答下列问题:
(1)I的最高化合价为__________,K的元素名称为__________。
(2)写出基态时Q元素原子的电子排布式__________,J元素原子的外围电子排布式________________。
(3)下列对比正确的是__________。
a.原子半径H>G>B>A
b.第一电离能E>D>C>B
c.电负性A>H>G>Q
d.最高价氧化物的水化物酸性B>A>H>G
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述不正确的是__________。
a.L位于元素周期表第五周期ⅠA族,属于s区元素
b.O位于元素周期表第七周期Ⅷ族,属于ds区元素
c.M的外围电子排布式为6s1,属于ds区元素
d.H所在族的外围电子排布式为ns2np2,属于p区元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种不溶于水的固体非金属氧化物,根据图中的转化关系,回答下列问题:
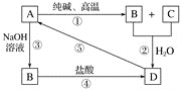
(1)写出化学式:A是____________,D是____________。
(2)写出相关反应的化学方程式:①____________,⑤____________。
(3)写出相关反应的离子方程式:②__________,③__________,④__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各实验装置的叙述中,正确的是
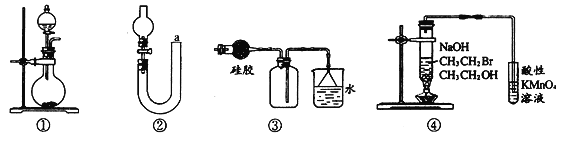
A. 装置①不可用于实验室制取少量NH3或O2
B. 可用从a处加水的方法检验装置②的气密性
C. 实验室可用装置③收集HCl
D. 验证溴乙烷发生消去反应生成烯烃的实验可利用装置④进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氯化铜是重要的无机杀菌剂,有多种组成,可表示为 Cua(OH)bClcxH2O。为测定某碱式氯化铜的 组成,进行下列实验:
(1)称取样品 1.1160g,用少量稀 HNO3 溶解后配成 100.00mL 溶液 A;
(2)取 25.00mL 溶液 A,加入足量 AgNO3 溶液,得 AgCl 0.1722g;
(3)另取 25.00mL 溶液 A,调节 pH 45,用浓度为 0.08000molL1 的 EDTA 标准溶液确定 A 中 Cu2+(原理为 Cu2++EDTA═EDTACu2+),消耗 EDTA 标准溶液 30.00mL。通过计算确定该样品的化学式( )
A. Cu2(OH)2Cl23H2O B. Cu2(OH)3ClH2O
C. Cu(OH)Cl2H2O D. Cu2(OH)Cl33H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com