
| 判断依据 | 结论(写结构简式)) |
| 核磁共振氢谱有1个峰 | ______ |
| 核磁共振氢谱有3个峰 | ______ |
| 3.6g |
| 18g/mol |
| 3.36L |
| 22.4L/mol |
| 2.4g |
| 16g/mol |
| 5.4g |
| 18g/mol |
| 4.4g |
| 44g/mol |
| 5.6L |
| 22.4L/mol |
| 2.8g |
| 28g/mol |
| 1.6g |
| 16g/mol |


 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案科目:高中化学 来源: 题型:阅读理解
| 物质 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ |
| FeSO4?7H2O | 15.6 | 20.5 | 26.5 | 32.9 | 40.2 | 48.6 | - |
| (NH4)2SO4 | 70.6 | 73.0 | 75.4 | 78.0 | 81.0 | - | 88.0 |
| (NH4)2SO4?FeSO4?6H2O | 12.5 | 17.2 | 21.0 | 28.1 | 33.0 | 40.0 | 44.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 判断依据 | 结论(写结构简式)) |
| 核磁共振氢谱有1个峰 | CH3OCH3 CH3OCH3 |
| 核磁共振氢谱有3个峰 | CH3CH2OH CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.4 |
| 第二次 | 10.00 | 4.00 | 24.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验操作 | 预期现象和结论 |
| 步骤1:取适量产物样品于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,取上层清液备用. | 有不溶的黑色固体. |
| 步骤2:取适量步骤1清液于试管中, |
|
| 步骤3: |
| 滴定 次数 |
待测溶液 的体积/mL |
消耗标准盐酸的体积 | |
| V1/mL | V2/mL | ||
| 1 | 25.00 | 15.02 | 4.97 |
| 2 | 25.00 | 14.98 | 5.03 |
| 3 | 25.00 | 13.21 | 6.75 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
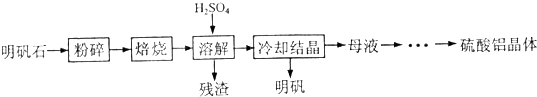
| 物质 | α-Al2O3 | γ-Al2O3 |
| 性质 | 不溶于水和酸 | 不溶于水,溶于强酸或强碱,加热至1200℃可转化为α-Al2O3 |
| 温度/℃ 溶解度/g |
0 | 20 | 40 | 60 | 80 | 100 |
| Al2(SO4)3 | 31.2 | 36.4 | 46.1 | 59.2 | 73.0 | 89.0 |
| 明矾 | 3.0 | 5.9 | 11.7 | 25 | 71 | 154 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com