
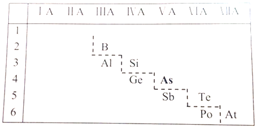
 ;砷蒸气的分子式:As4,其分子结构与白磷(P4)相似,也是正四面体,则As4中砷砷键的键角是60°.
;砷蒸气的分子式:As4,其分子结构与白磷(P4)相似,也是正四面体,则As4中砷砷键的键角是60°.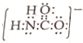 .
.分析 (1)As的最外层有5个电子;As4分子结构与白磷(P4)相似,也是正四面体,键角为60°;
(2)电子层越多,对电子的吸引越弱,As位于金属与非金属的交界处;
(3)该反应中N元素化合价由-3价、+5价变为0价,O元素的化合价由-2价升高为0,则氮气既是氧化产物也是还原产物,转移电子个数为10;
(4)①阴离子中为共价键结合;
②pH=11的氨水中,c(H+)=10-11mol/L,c(OH-)=10-3mol/L,结合电荷守恒计算.
解答 解:(1)As的最外层有5个电子,As原子最外层电子的轨道表示式为 ;As4分子结构与白磷(P4)相似,也是正四面体,键角为60°,
;As4分子结构与白磷(P4)相似,也是正四面体,键角为60°,
故答案为: ;60°;
;60°;
(2)P的非金属性比As强,从原子结构的角度解释其原因为 P原子核外有三个电子层,As原子核外有四个电子层,P的原子半径<As,P吸引电子的能力更强,所以P的非金属性更强;由位置可知,砷是半导体,则砷的氧化物是两性氧化物、砷的最高价氧化物对应水化物是两性氢氧化物等,
故答案为:P原子核外有三个电子层,As原子核外有四个电子层,P的原子半径<As,P吸引电子的能力更强,所以P的非金属性更强;砷是半导体,则砷的氧化物是两性氧化物、砷的最高价氧化物对应水化物是两性氢氧化物;
(3)该反应中N元素化合价由-3价、+5价变为0价,O元素的化合价由-2价升高为0,则氮气既是氧化产物也是还原产物,氧气为氧化产物,转移电子个数为10,则每生成2molN2,反应中转移的电子为10mol,氧化产物与还原产物的质量之比为(32+28):28=15:7,
故答案为:10;15:7;
(4)①NH2COO-的电子式为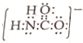 ,故答案为:
,故答案为: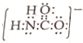 ;
;
②pH=11的氨水中,c(H+)=10-11mol/L,c(OH-)=10-3mol/L,由电荷守恒可知,c(NH4+)=10-3-10-11(或10-3)mol/L,故答案为:10-3-10-11(或10-3).
点评 本题考查氧化还原反应计算及周期表和周期律的综合应用,为高频考点,把握反应中元素的化合价变化、元素周期律应用等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | “液氯”是纯净物而“氯水”是混合物 | |
| B. | Fe(OH)3胶体无色、透明,能发生丁达尔现象 | |
| C. | NO2溶于水发生了氧化反应,它既是氧化剂又是还原剂 | |
| D. | 用玻璃棒分别蘸取浓盐酸和浓氨水并互相靠近,能看到白烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
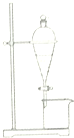
| A. | 用CCl4提取碘水中的碘 | |
| B. | 用NaOH溶液除去溴苯中的溴 | |
| C. | 用酒精除去苯酚中的甘油 | |
| D. | 用饱和Na2CO3溶液除去乙酸丁酯中的乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 可以表示:Ca(HCO3)2溶液与Ca(OH)2溶液的反应 | |
| B. | 不能表示:Ca(HCO3)2溶液与Ba(OH)2溶液反应 | |
| C. | 可以表示:Ca(HCO3)2溶液与NaOH溶液反应 | |
| D. | 不能表示:NaHCO3溶液与Ca(OH)2溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤液化制得清洁能源 | B. | 用酒精测试仪检测酒驾 | ||
| C. | 将氯气通入冷的消石灰中制漂白粉 | D. | 从海水中提取氯化镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | ||
| Y | Z | W |
| T |
| A. | X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增 | |
| B. | Y、Z、X元素在自然界中均不能以游离态存在,它们氧化物对应水化物的酸性依次递增 | |
| C. | 根据元素周期律推测,金属性T比Y强 | |
| D. | W、Z的最高价对应的氧化物熔化时破坏的作用力相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNa2O2固体中含离子总数为4NA | |
| B. | 用双氧水分解制取0.1mol氧气,转移的电子总数为0.4×6.02×1023 | |
| C. | 0.1molAlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒 | |
| D. | VL amol•L-1的氯化铁溶液中,若Fe3+的数目为6.02×1023,则Cl-的数目大于3×6.02×1023 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com