
 ��1�����淴ӦN2��g��+3H2��g��2NH3��g����һ�����ȷ�Ӧ���м���������ȫ��ͬ����������������м���1molN2��3molH2��һ�������£��ﵽƽ��ʱ�ų�������ΪQ1����ͬ�����£����������м���2molNH3���ﵽƽ��ʱ�����յ�����ΪQ2����֪Q2=4Q1�����������H2��ת����Ϊ
��1�����淴ӦN2��g��+3H2��g��2NH3��g����һ�����ȷ�Ӧ���м���������ȫ��ͬ����������������м���1molN2��3molH2��һ�������£��ﵽƽ��ʱ�ų�������ΪQ1����ͬ�����£����������м���2molNH3���ﵽƽ��ʱ�����յ�����ΪQ2����֪Q2=4Q1�����������H2��ת����Ϊ| ��c |
| ��t |
| 2-2x |
| 2 |
| 0.2mol��3 |
| 3mol |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
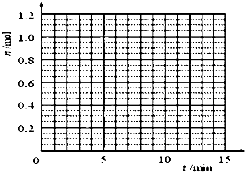
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
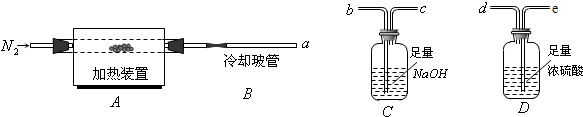
 ��ͼ��ʵ������ȡijЩ�����װ�ã�
��ͼ��ʵ������ȡijЩ�����װ�ã��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ƿ��ʢ������ŨH2SO4����A�ڽ���������NH3 |
| B����B�ڽ��������ſ������ռ�CO2 |
| C��ƿ��ʢ��ˮ����B�ڽ���������ˮ���ռ�NO2 |
| D��ƿ��װ��ˮ��A�����ӵ��ܲ�������Ͳ�У���B�ڽ���������ˮ����������H2����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ʵ��װ�ñ��¡�����Ч���� |
| B����ȡNaOH��Һ�����ʱ���Ӷ��� |
| C���ֶ�ΰ�NaOH��Һ����ʢ�������С�ձ��� |
| D�����¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�ֱ�ӲⶨH2SO4��Һ���¶� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com