
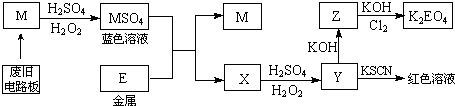
 某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,pH值随溶液体积变化的曲线如图所示.据图判断正确的是( )
某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,pH值随溶液体积变化的曲线如图所示.据图判断正确的是( )| A. | 水电离程度d<a<b<c | |
| B. | b点溶液的导电性比c点溶液的导电性弱 | |
| C. | a点KW的数值比c点KW的数值大 | |
| D. | b点酸的总浓度大于a点酸的总浓度 |
分析 根据盐酸是强酸,完全电离,醋酸是弱酸,部分电离,相同温度下,相同pH值的盐酸和醋酸溶液,醋酸浓度大,溶液稀释时,醋酸进一步电离,其溶液中离子浓度大于盐酸的离子浓度,故II应为醋酸稀释时的pH值变化曲线,
A、溶液的PH越小,氢离子浓度越大,水电离程度越小;
B、溶液导电性取决于离子浓度;
C、Kw的大小只取决于温度;
D、相同pH值的盐酸和醋酸,醋酸浓度大于盐酸的浓度.
解答 解:盐酸是强酸,完全电离,醋酸是弱酸,部分电离,相同温度下,相同pH值的盐酸和醋酸溶液,醋酸浓度大,溶液稀释时,醋酸进一步电离,其溶液中离子浓度大于盐酸的离子浓度,故II应为醋酸稀释时的pH值变化曲线,
A、溶液的PH越小,氢离子浓度越大,水电离程度越小,则水电离程度d<a<b<c,故A正确;
B、溶液导电性取决于离子浓度,b点的H+浓度大,导电性强,故B错误;
C、Kw的大小只取决于温度,温度相同,Kw相同,所以a点KW的数值与c点KW的数值相同,故C错;
D、相同pH值的盐酸和醋酸,醋酸浓度大于盐酸的浓度,稀释到相同体积时,a点酸的总浓度大于b点酸的总浓度,故D错.
故选A.
点评 本题考查强弱电解质溶液稀释时的浓度变化,注意加水促进弱电解质电离的特点,题目难度不大,侧重于考查学生的分析能力和读图能力.


科目:高中化学 来源: 题型:填空题
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| V(M)(x10-3mol.L-1.min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol•L-1的氨水溶液中c(OH-)=0.01 mol•L-1 | |
| B. | 常温下,将pH为12的氨水溶液加水稀释100倍,稀释后的溶液pH大于10 | |
| C. | 10 mL 1 mol•L-1的氨水溶液恰好与10 mL 1 mol•L-1的盐酸完全反应 | |
| D. | 在相同条件下,氨水溶液的导电性比NaOH溶液弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | |
| B. | 溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变 | |
| C. | 溶液中导电粒子的数目增加 | |
| D. | 再加入10 mL pH=11的NaOH溶液,恰好完全中和 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,17 g ND3中所含分子数目NA | |
| B. | 25℃,pH=11的Na2CO3溶液中由水电离出的H+的数目为10-3NA | |
| C. | 用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.4NA | |
| D. | 6g SiO2所含分子数为0.1NA,化学键总数为0.4 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com