
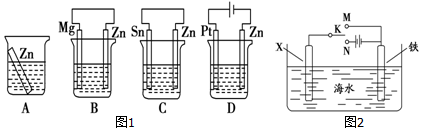
分析 (1)金属腐蚀快慢顺序是:电解池阳极>原电池负极>化学腐蚀>原电池正极>电解池阴极;
(2)作原电池正极或作电解池阴极的金属被保护.
解答 解:(1)金属腐蚀快慢顺序是:电解池阳极>原电池负极>化学腐蚀>原电池正极>电解池阴极,根据图知,B中锌作正极、C中锌作负极、D中锌作阴极,所以锌被腐蚀快慢顺序是:C>A>B>D,则被腐蚀最快的是C;
故答案为:C;
(2)作原电池正极或作电解池阴极的金属被保护,若X为碳棒,为减缓铁的腐蚀,则铁应作电解池阴极,所以开关K应该置于处N处;
若X为锌,开关K置于M处,该装置构成原电池,锌易失电子作负极,铁作正极而被保护,该电化学防护法称为牺牲阳极的阴极保护法,
故答案为:N;牺牲阳极的阴极保护法.
点评 本题考查了金属被腐蚀快慢顺序,原电池、电解池原理的分析判断,掌握基础是关键,题目难度中等.


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:选择题
| A. | 铈(Ce)元素在自然界中主要以化合态形式存在 | |
| B. | 铈溶于氢碘酸的化学方程式可表示为:Ce+4HI═CeI4+2H2↑ | |
| C. | 用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+═Ce3++Fe3+ | |
| D. | 四种稳定的核素58136Ce、58138Ce、58140Ce、58142Ce,它们互称为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol CO+2.0 mol H2O(g)+1.0 mol CO2+1.0 mol H2 | |
| B. | 1.0 mol CO+2.0 mol H2O(g)+0.5 mol He | |
| C. | 1.0 mol CO+1.0 mol H2O(g)+1.0 mol CO2+1.0 mol H2 | |
| D. | 0.5 mol CO+1.5 mol H2O(g)+0.4 mol CO2+0.4 mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 轮船水线以下的船壳上装上一定数量的锌块 | |
| B. | 银质奖章久置后表面变暗 | |
| C. | 黄铜(铜锌合金)制作的铜锣不易产生铜绿 | |
| D. | 纯锌与稀H2SO4反应滴入少量的CuSO4溶液后反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 热化学方程式中的化学计量数只表示物质的量,可以是分数 | |
| C. | 1 mol H2SO4与1 mol Ba(OH)2反应放出的热叫做中和热 | |
| D. | 1 mol H2与0.5 mol O2反应放出的热就是H2的标准燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
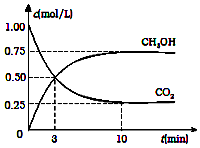 降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为2L的恒容密闭容器中,充入2mol CO2和6mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:
降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为2L的恒容密闭容器中,充入2mol CO2和6mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上第一次月考化学试卷(解析版) 题型:填空题
反应3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g),在一可变的容积的密闭容器中进行,试回答:
Fe3O4(s)+4H2(g),在一可变的容积的密闭容器中进行,试回答:
①增加Fe的量,其正反应速率的变化是 (填增大、不变、减小,以下相同)
②将容器的体积缩小一半,其正反应速率 ,逆反应速率 。
③保持体积不变,充入N2使体系压强增大,其正反应速率 ,逆反应速率 。
④保持压强不变,充入N2使容器的体积增大,其正反应速率 ,逆反应速率 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上第一次月考化学试卷(解析版) 题型:选择题
下列是4位同学在学习“化学反应速率和化学平衡”一章后,联系工业生产实际所发表的观点,你认为不正确的是( )
A. 化学反应速率理论是研究怎样在一定时间内快出产品
B. 化学平衡理论是研究怎样使用有限原料多出产品
C. 化学平衡理论是研究怎样使原料尽可能多地转化为产品
D. 化学反应速率理论是研究怎样提高原料转化率
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省唐山市高二上10月月考化学试卷 (解析版) 题型:选择题
在体积可变的容器中发生反应N2 + 3H2  2NH3 ,当增大压强使容器体积缩小时,化学反应速率加快,其主要原因是( )
2NH3 ,当增大压强使容器体积缩小时,化学反应速率加快,其主要原因是( )
A.分子运动速率加快,使反应物分子间的碰撞机会增多
B.活化分子百分数未变,但单位体积内活化分子数增加,有效碰撞次数增多
C.反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多
D.分子间距离减小,使所有的活化分子间的碰撞都成为有效碰撞
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com