
【题目】联碱法(侯氏制碱法)和氨碱法的生产流程简要表示如下:
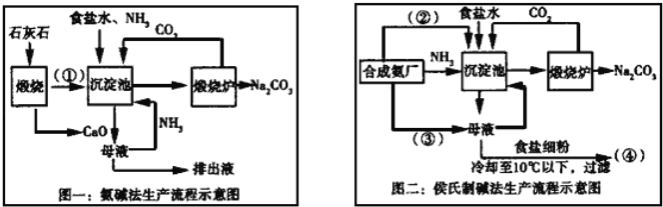
完成下列填空:
(1)写出化学式:②_____、③____
(2)从理论上分析,氨碱法生产过程中_____(选填“需要”、“不需要”)补充氨气,写出该工艺中生成CaCl2的化学方程式________________。
(3)对联碱法中从母液中提取氯化铵晶体的过程进行分析,所得结论合理的是______。
a.常温时氯化铵的溶解度比氯化钠小
b.通入氨气可把碳酸氢钠转化为碳酸钠,防止碳酸氢钠析出
c.加入食盐细粉目的是提高Na+的浓度,促进碳酸氢钠结晶析出
(4)取“侯氏制碱法”生产的纯碱样品5.500g,配成500mL溶液,取25mL溶液用0.1000mol/L的标准盐酸滴定(设其中的杂质不与盐酸反应),用酚酞作指示剂,三次滴定消耗盐酸的平均量为25.00mL.计算样品中纯碱的质量分数______。(已知25℃时0.1mol/L的NaHCO3溶液的pH约为8.3)某活动小组根据上述制碱原理,用如下所示装置(夹持装置省略)制备碳酸氢钠.
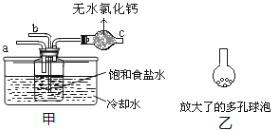
(5)实验时,须先从____管通入_____气体,再从_____管中通入_____气体。
(6)有同学建议在甲装置的b管下端连接乙装置,目的是________________________________。
【答案】CO2 NH3 不需要 2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O b 96.4% a 氨气 b 二氧化碳 增大二氧化碳与溶液接触面积,使其充分反应
【解析】
(1)根据流程图分析;
(2)氨碱法生产过程中,母液中加入氧化钙反应生成的氢氧化钙会和铵盐生成氨气,反应过程中氨气转化为铵盐,铵盐转化为氨气,氨气循环使用;氢氧化钙与氯化铵反应生成氯化钙、氨气和水;
(3)根据母液中通入氨气、食盐会析出氯化铵晶体进行分析;
(4)用酚酞作指示剂,盐酸滴定碳酸钠溶液,根据反应方程式计算;
(5)通氨气时要防止倒吸,则导管不能直接深入液面以下,由于二氧化碳的溶解度较小,要先通氨气;
(5)多孔球泡能增大二氧化碳与溶液的接触面积。
(1)联碱法生产流程中沉淀池中发生的反应是氨气、二氧化碳、水、氯化钠反应生成碳酸氢钠晶体和氯化铵,所以通入沉淀池中的是二氧化碳,即②为CO2,母液中通入氨气再重新利用,则③为NH3;
(2)从理论上分析,氨碱法生产过程中,母液中加入氧化钙反应生成氢氧化钙会和铵盐生成氨气,反应过程中氨气转化为铵盐,铵盐转化为氨气,氨气循环使用,不需要补充氨气;
CaO与水反应生成氢氧化钙,氢氧化钙与氯化铵反应生成氯化钙,则该工艺中生成CaCl2的化学方程式Ca(OH)2+2NH4Cl═CaCl2+2NH3↑+2H2O;
(3)a.常温时氯化铵的溶解度比氯化钠大,故a错误;
b.通氨气能增大NH4+的浓度,使NH4Cl更多地析出,使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度,故b正确;
c.加入食盐细粉目的是提高Cl﹣的浓度,促进氯化铵结晶析出,故c错误;
(4)已知25℃时0.1mol/L的NaHCO3溶液的pH约为8.3,则用酚酞作指示剂滴定时,发生的反应为Na2CO3+HCl=NaHCO3+NaCl,
则n(Na2CO3)=0.1000mol/L×0.025L×![]() =0.05mol,
=0.05mol,
m(Na2CO3)=nM=0.05mol×106g/mol=5.3g,
样品中纯碱的质量分数:![]() ×100%=96.4%;
×100%=96.4%;
(5)向溶液中通氨气时要防止倒吸,则导管不能直接深入液面以下,由于二氧化碳的溶解度较小,要先通氨气,则先由a管通入氨气,再由通入二氧化碳;
(6)在甲装置的b管下端连接多孔球泡,能增大二氧化碳与溶液的接触面积,使二氧化碳充分溶解。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】下列关于碳和碳的化合物的结构和性质中
(1)和碳同一主族的硅原子中能量最高的电子处在______电子层上(填写电子层符号),最外层有___种运动状态不同的电子,碳原子核外有______种能量不同的电子,有______种不同形状的电子云.
(2)1个C原子的单键氢化物分子是CH4,2个C原子的单键氢化物分子则为C2H6.以下各对分子间不存在类似关系的是_________
A.NH3与N2H4 B.H2O与H2O2 C.SF6与S2F10 D.SCl4与S2Cl2
(3)金刚石的熔点低于石墨,原因可能是________
A.石墨中还有范德华力
B.石墨熔化也要破坏共价键,且键长更短
C.石墨热稳定性更好
(4)已知常温下,H2CO3:Ki1=4.3x10﹣7、Ki2=5.6x10﹣11.结合H+的能力Na2CO3溶液______(填”>”、”<”或“=”)NaHCO3溶液,设计简单实验证明:______.
(5)在1L 0.3mol/L的NaOH溶液中,通入4.48LCO2(标准状况),反应后所得溶液中离子的浓度之间有一些等量关系,例如:.c(Na+)+c(H+)=c(HCO3﹣)+2c(CO32﹣)+c(OH﹣),另外对此溶液中存在的离子按浓度由大到小排序为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮有多种化合价,能形成多种化合物.工业上用活性炭还原法处理NO,有关反应为:C(s)+2NO(g)N2(g)+CO2(g).向密闭的2L容器中,加入NO和足量的活性炭,恒温条件下反应.
(1)若2min内气体密度增大了1.2g/L,则氮气的平均反应速率为_____mol/(Lmin).
(2)该化学平衡常数表达式K=_____,已知升高温度时,K增大,则正反应为_____(填“吸热”或“放热”)反应.
(3)在温度不变的情况下,要提高NO的平衡转化率,可以采取的措施是_______.
(4)下列各项能判断该反应达到平衡的是______(填序号字母).
a.容器内压强保持不变 b.2v正(NO)=v逆(N2)
c.容器内CO2的体积分数不变 d.混合气体的密度保持不变
(5)已知NaNO2溶液呈碱性,则NaNO2溶液中离子浓度由大到小的顺序是______.
(6)常温下,NaOH溶液和HNO2溶液等体积混合后,所得溶液的pH=7,下列关系正确的是________.
a.c(Na+)>c(NO2﹣) b.c(Na+)=c(NO2﹣)
c.c(Na+)<c(NO2﹣) d.c(Na+)>c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钾与碳酸氢钾都是重要的化学试剂与工业原料,具有广泛的用途.
(1)将碳酸钾、石灰石和二氧化硅进行高温煅烧,可得到组成为K2OCaO6SiO2的钾玻璃,同时排出CO2.若制造5.1kg钾玻璃,排放的CO2在标准状况下的体积是_____L.
(2)已知亚硫酸的酸性强于碳酸.工业上用碳酸钾与碳酸氢钾的混合溶液吸收SO2,充分反应后,所得溶液组成如下表:
物质 | K2CO3 | KHCO3 | K2SO3 |
质量(kg) | 55.2 | 120.0 | 63.2 |
计算原吸收液中碳酸钾与碳酸氢钾的物质的量之比_______________.
(3)根据上表中的数据,计算上表的混合溶液还能吸收SO2的最大质量(不计SO2的溶解)._____________
(4)将热的浓CuSO4溶液与K2CO3溶液混合,析出物中有一种蓝色粒状晶体(不含结晶水),式量为376,其中钾元素的质量分数为0.104.取0.02mol该晶体溶于足量的稀盐酸中,没有气体产生,再加入BaCl2,产生9.32g白色沉淀,通过计算推断晶体的化学式.___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知蓄电池在充电时作电解池,放电时作原电池.如图是铅蓄电池的工作示意图,其反应原理为:PbO2+Pb+2H2SO4![]() 2PbSO4+2H2O下列说法中错误的是( )
2PbSO4+2H2O下列说法中错误的是( )
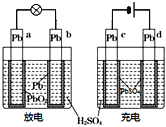
A.b电极放电后转化为c电极
B.电极a和d都发生还原反应
C.b的电极反应式:Pb+SO42﹣﹣2e-→PbSO4
D.放电后硫酸溶液的pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中第VIIA族元素的单质及其化合物的用途广泛.完成下列填空:
(1)与氯元素同族的短周期元素的原子核外有___种不同能量的电子.
(2)能作为溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是___(填序号).
a.IBr中溴为﹣1价 b.HBr、HI的酸性c.HBr、HI的热稳定性 d.Br2、I2的熔点
(3)海水提溴过程中,先向浓缩海水中通入_____,将其中的Br﹣氧化,再用“空气吹出法”吹出Br2,并用纯碱吸收.已知纯碱吸收溴的主要反应是:Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(未配平),则吸收1mol Br2,转移电子_____mol,反应中氧化产物为_____.
(4)已知:AlF3的熔点为1040℃,AlCl3在178℃升华.从物质结构的角度解释两者熔点相差较大的原因:__________
(5)HClO有很好的杀菌消毒效果.为增强氯水的杀菌能力,可以用饱和氯水与小苏打反应来达到目的,试用平衡移动原理解释其原因:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某恒温密闭容器中,可逆反应A(s)![]() B+C(g)-Q达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
B+C(g)-Q达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
A.产物B的状态只能为固态或液态
B.平衡时,单位时间内n(A)消耗﹕n(C)消耗=1﹕1
C.保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动
D.若开始时向容器中加入1molB和1molC,达到平衡时放出热量Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于![]() 的分子结构,下列说法正确的是( )
的分子结构,下列说法正确的是( )
A. 除苯环外的其余碳原子有可能都在一条直线上
B. 除苯环外的其余碳原子不可能都在一条直线上
C. 12个碳原子不可能都在同一平面上
D. 所有原子有可能都在同一平面上
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com