
| A、促进、促进 |
| B、促进、抑制 |
| C、抑制、促进 |
| D、抑制、抑制 |


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
| A、室温下,106g碳酸钠固体所含有的离子总的物质的量小于3mol |
| B、在同压不同温的情况下,质量相同的氧气和臭氧所含氧原子数不相同 |
| C、将物质的量浓度分别为1mol/L和2mol/L的硫酸等质量混合(假设体积可以加和),则混合后硫酸溶液的浓度为1.5mol/L |
| D、标况下,22.4L CH3Cl分子数约为6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2通入品红溶液,溶液褪色的原理与SO2通入溴水后褪色的原理相同 |
| B、浓硫酸具有强氧化性,稀硫酸不具有氧化性 |
| C、用浓FeCl3溶液和NaOH溶液混合制备Fe(OH)3胶体 |
| D、明矾和漂白粉常用于自来水的净化和杀菌消毒,但二者的作用原理不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、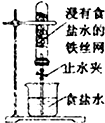 一段时间后打开止水夹,观察到导管中液面上升,因为铁发生了吸氧腐蚀 |
B、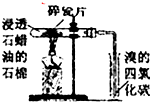 加热一段时间,观察到溴的四氯化碳溶液颜色褪去,因为有气态烯烃产生 |
C、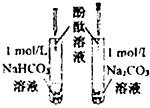 溶液均变红,碳酸钠溶液颜色较深,因为相同条件下水解能力HCO3-强于CO32- |
D、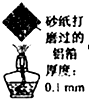 加热一段时间,观察到熔化的铝未滴落,因为铝表面生成氧化铝的熔点很高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
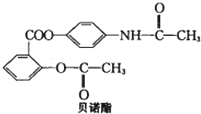
| A、分子式为C17H14O5N |
| B、在氢氧化钠水溶液中水解可以得到3种有机物钠盐 |
| C、1mol贝诺酯与H2发生加成反应最多消耗8mol H2 |
| D、贝诺酯既属于酯类又属于蛋白质类 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钠的水解:CO32-+2H2O?H2CO3+2OH- |
| B、钠和水反应:Na+2H2O═Na++2OH-+H2↑ |
| C、用过氧化氢从酸化海带灰浸出液中提取碘:2I-+H2O2═I2+2OH- |
| D、向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可用使铁钝化的方法来减缓铁的腐蚀 |
| B、除去CO气体中的少量氧气可让气体通过加热的铜网 |
| C、不论将铝箔加热到什么样的温度均是只熔化而不滴落下来 |
| D、等质量的铝与盐酸或氢氧化钠溶液反应时产生的氢气体积一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氨和肼(N2H4)是氮的两种常见氢化物,在科学技术和生产中有重要的应用.
氨和肼(N2H4)是氮的两种常见氢化物,在科学技术和生产中有重要的应用.| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 7.1 | 50.6 | 3.8 |
| n(NH3) |
| n(CO2) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com