
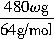 ×250g/mol+
×250g/mol+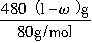 ×250g/mol=(1500+375ω)g。
×250g/mol=(1500+375ω)g。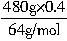 =3mol,n(CuO)=
=3mol,n(CuO)=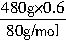 =3.6mol,所以n(Cu)+n(CuO)=n(CuSO4?5H2O)=n(H2SO4)=6.6mol。
=3.6mol,所以n(Cu)+n(CuO)=n(CuSO4?5H2O)=n(H2SO4)=6.6mol。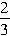 n(Cu)=2mol,故n(HNO3)∶n(H2SO4)=1∶3.3。
n(Cu)=2mol,故n(HNO3)∶n(H2SO4)=1∶3.3。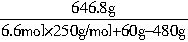 =52.6%
=52.6% 

 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来.由实验现象所得出的有关Na2O2和H2O反应的结论是:
(1)用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来.由实验现象所得出的有关Na2O2和H2O反应的结论是:查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (2011?山西模拟)甲醛是重要的有机合成原料,大量用于生产树脂、合成纤维、药物、涂料等,也是世界卫生组织(WHO)确认的致癌物和致畸物质之一.据中国室内环境监测工作委员会调查统计,中国新装家庭甲醛超标60%以上.我国规定室内空气中甲醛含量不得超过0.08mg/m3.
(2011?山西模拟)甲醛是重要的有机合成原料,大量用于生产树脂、合成纤维、药物、涂料等,也是世界卫生组织(WHO)确认的致癌物和致畸物质之一.据中国室内环境监测工作委员会调查统计,中国新装家庭甲醛超标60%以上.我国规定室内空气中甲醛含量不得超过0.08mg/m3.| 1 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
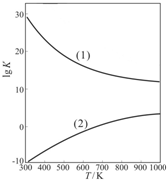
| 1 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
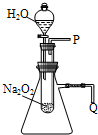 用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,向脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来.
用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,向脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com