
向一定量的Mg2+、NH4+、Al3+混合溶液中加入Na2O2的量与生成沉淀和气体的量(纵坐标)的关系如图所示,则溶液中三种离子的物质的量之比为
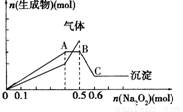
A.2:1:2 B.1:2:2 C.2:2:1 D.9:2:4
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源:2017届河北省高三上学期周练(8.28)化学试卷(解析版) 题型:选择题
关于硅的叙法不正确的是
A.高纯硅是良好的半导体
B.硅是制造太阳能电池的常用材料
C.硅的化学性质不活泼,常温下不与任何物质反应
D.硅在地壳中含量居第二位,但在自然界中没有游离态的硅存在
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一上开学测化学试卷(解析版) 题型:实验题
NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
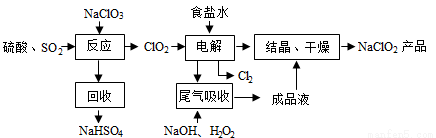
回答下列问题:
(1)“电解”所用食盐水由粗盐水精制而成,精制时为除去Mg2+和Ca2+,要加入的试剂分别
为______、________。
(2)写出“反应”步骤中生成ClO2的化学方程式____________。
(3)实验所用原料硫酸是由浓硫酸稀释而获得,写出实验过程_____________。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应中,氧化剂与还原剂的物质
的量之比为_______。
(5)将lmol SO2和lmol Cl2通入水中形成lL的溶液,所得溶液中氢离子浓度为_______mol/L。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一上开学测化学试卷(解析版) 题型:选择题
下列说法中不正确的是
A. 电子数相同的粒子不一定属于同种元素
B. 两个原子如果核外电子排布相同,一定属于同种元素
C. 质子数相同,电子数也相同的两种粒子,不可能是一种分子和一种离子
D. 所含质子数和电子数相等的粒子一定是原子
查看答案和解析>>
科目:高中化学 来源:2017届重庆一中高三上学期开学测理综化学试卷(解析版) 题型:实验题
我国市售加碘食盐中含有碘酸钾。已知碘酸钾在酸性条件下是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。工业生产碘酸钾的流程如下:
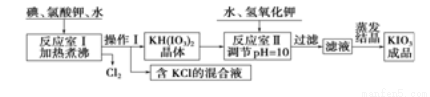
请回答下列问题:
(1)已知反应室Ⅰ发生的反应中,两种还原产物所得电子数相同,请写出该反应的化学方程式: 。
(2)反应室Ⅰ需加热煮沸,其目的是:①加快反应速率,使反应物充分反应:② (请从化学平衡角度解释)。
(3)已知几种物质的溶解度见下表:
KCl | KH(IO3)2 | KClO3 | |
溶解度g/100 g水(25 ℃) | 20.8 | 0.8 | 7.5 |
溶解度g/100 g水(80 ℃) | 37.1 | 12.4 | 16.2 |
由上表数据分析可知,操作Ⅰ的名称为 、 。
(4)在反应室Ⅱ中加入KOH调节溶液的pH=10,其目的是 。
(5)甲同学欲测定成品中碘酸钾的含量,设计了如下实验:
①准确称取1 g样品,加适量蒸馏水使其完全溶解;
②用稀硫酸酸化上述所得溶液,加入过量KI溶液,充分搅拌;
③以淀粉为指示剂,逐滴加入2.0 mol·L-1的Na2S2O3溶液,当蓝色刚好褪去时,消耗Na2S2O3溶液12.00 mL,则成品中KIO3的质量分数为 (列式计算,结果保留三位有效数字)
(已知:KIO3+5KI+3H2SO4===3K2SO4+3I2+3H2O,I2+2Na2S2O3===2NaI+Na2S4O6)。
(6)乙同学又对纯净的NaCl(不含KIO3)进行了下列实验:
操作步骤 | 实验现象 |
取1g纯净的NaCl,加3mL水配成溶液。 | 溶液无变化 |
滴入5滴淀粉溶液和1mL 0.1mol/L KI溶液,振荡。 | 溶液无变化 |
然后再滴入1滴1mol/L的H2SO4,振荡。 | 溶液变蓝色 |
①请推测实验中产生蓝色现象的可能原因,用离子方程式表示 。
②根据乙同学的实验结果推测,甲同学的实验结果会 (填“偏大”,“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源:2017届山西省等五校高三上学期第一次联考化学试卷(解析版) 题型:填空题
NO2气体对环境有危害,应特别注意对地表水、土壤、大气和饮用水的污染。在一定温度时,将0.80 mol的NO2气体充入4 L真空的密闭容器中,每隔一段时间就对该容器内的物质进行分析,得到数据如下表所示:
时间(s) | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.80 | n1 | 0.52 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.10 | n2 | 0.16 | 0.16 |
(1)在上述条件下,反应从20 s至40 s这一时间段内,NO2的平均反应速率为 mol·L-1·s-1。
(2)n3________n4(填“>”、“<”或“=”),该反应的平衡常数为 (保留小数点后一位)。
(3)达到平衡后,如向该密闭容器中再充入0.64 mol氦气,并把容器体积扩大为8 L,则平衡将______(选填“向正反应方向移动”、 “向逆反应方向移动”或“不移动”),其理由是 。
(4)若在相同情况下,最初向该容器中充入的是N2O4气体,要达到上述同样的平衡状态,起始充入N2O4的物质的量是 mol,假设在80 s时达到平衡,请在图中画出并标明该条件下此反应中N2O4和NO2的浓度随时间变化的曲线。
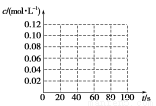
(5)取五等份NO2,分别加入温度不同、容积相同的恒容密闭容器中,反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是 。


查看答案和解析>>
科目:高中化学 来源:2017届山西省等五校高三上学期第一次联考化学试卷(解析版) 题型:选择题
如图所示,将充满NO2气体的三个烧瓶关闭弹簧夹后,分别置于盛有下列物质的烧杯(烧杯内有水)中,下列叙述正确的是
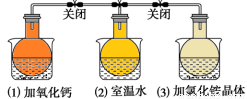
A.烧瓶(3)中气体颜色最深
B.NH4Cl溶于水时放出热量
C.2NO2 N2O4是放热反应
N2O4是放热反应
D.烧瓶(2)中气体的压强比(1)大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上9月调研化学试卷(解析版) 题型:填空题
密闭容器中加入4 mol A、1.2 mol C和一定量的B三种气体,一定条件下发生反应,各物质的浓度随时间变化如甲图所示[已知t0~t1阶段保持恒温、恒容,且c(B)未画出]。乙图为t2时刻后改变反应条件,反应速率随时间的变化情况,已知在t2、t3、t4、t5时刻各改变一种不同的条件,其中t3时刻为使用催化剂。

(1)若t1=15 s,则t0~t1阶段的反应速率为v(C)=___________。
(2)t4时刻改变的条件为____________,B的起始物质的量为______________。
(3)t5时刻改变的条件为____________,该反应的逆反应为__________(填“吸热反应”或“放热反应”)。
(4)图乙中共有Ⅰ~Ⅴ五处平衡,其平衡常数最大的是__________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一上开学测化学试卷(解析版) 题型:选择题
汞是银白色闪亮的重质液体,化学性质稳定,不溶于酸也不溶于碱。汞常温下即可蒸发,汞蒸发气和汞的化合物多有剧毒(慢性),汞使用的历史很悠久,用途很广泛,如图是汞在元素周期表中的相关信息,关于汞的说法正确的是( )
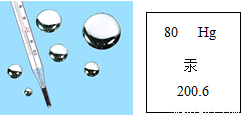
A.汞属于非金属元素 B.汞原子中质子与中子数之和为200.6
C.汞原子中电子数为80 D.汞不能与其他物质发生化学反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com