
设NA为阿伏加德罗常数,下列说法中不正确的是
A.标准状况下,1.12L的H2O所含的原子数大于0.15NA
B.常温常压下,1mol甲基(—14C1H3)所含有的中子数和电子数分别为8NA和9NA
C.某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA
D.在1L0.1mol·L-1碳酸钠溶液中,阴离子总数大于0.1NA
C
【解析】
试题分析:A、标准状况下,1.12L水的质量是1120g,物质的量远大于0.5mol,所以含有的原子总数大于0.15NA,正确;B、一个甲基(—14C1H3)所含有的中子数和电子数分别是14-6=8、6+3=9,所以1mol甲基(—14C1H3)所含有的中子数和电子数分别为8NA和9NA,正确;C、某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,因为该反应是可逆反应,所以转移电子的数目小于0.6NA,错误;D、在1L0.1mol·L-1碳酸钠溶液中碳酸根离子的总物质的量是0.1mol,由于碳酸根离子水解生成碳酸氢根离子和氢氧根离子,使阴离子数增多,所以阴离子总数大于0.1NA,正确,答案选C。
考点:考查阿伏伽德罗常数与粒子数的关系判断


科目:高中化学 来源:2014-2015学年浙江省高三上学期期中考试化学试卷(解析版) 题型:选择题
将钠、铝混合物W1g投入一定量水中充分反应,金属没有剩余,共收集到标准状况下的气体V1L。向反应后的溶液中逐滴加入浓度为a mol·L-1的盐酸,在此过程中有白色沉淀生成后又逐渐溶解,当沉淀恰好消失时所加盐酸体积为V2L,将溶液蒸干、灼烧得固体W2g。下列关系式错误的是
A.35.5aV2=W2-W1 B.23n(Na)+27n(Al)=W1
C.n(Na)+3n(Al)=2V1/22.4 D.aV2=V1/11.2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省焦作市高三上学期期中化学试卷(解析版) 题型:选择题
能区别地沟油(加工过的餐饮废弃油)与矿物油(汽油、煤油、柴油等)的方法是
A.点燃,能燃烧的是矿物油
B.测定沸点,有固定沸点的是矿物油
C.加入水中,浮在水面上的是地沟油
D.加入足量氢氧化钠溶液共热,不分层的是地沟油
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省等四校高三上学期期中联考化学试卷(解析版) 题型:填空题
(8分)常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式_______ __ ___。
(2)若溶液M由10 mL 2 mol·L-1 NaHA溶液与2 mol·L-1 NaOH溶液等体积混合而得,
则溶液M的pH_ __7(填“>”、“<”或“=”),溶液中离子浓度由大到小顺序为_ _ __。
(3)若溶液M有下列三种情况:
①0.01 mol·L-1的H2A溶液
②0.01 mol·L-1的NaHA溶液
③0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合液,
则三种情况的溶液中H2A分子浓度最大的为___ ___;pH由大到小的顺序为__ ____。
(4)若溶液M由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液c(H+)/c(OH-)=104,V1与V2的大小关系为___ _____(填“大于、等于、小于”或“均有可能”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省等四校高三上学期期中联考化学试卷(解析版) 题型:选择题
汽车剧烈碰撞时,安全气囊中发生反应: 。则下列判断错误的是
。则下列判断错误的是
A.该反应能在瞬间完成,并产生大量气体
B.生成标准状况下2.24L气体,该反应转移电子的物质的量为0.5mol
C.该反应中的氧化剂为KNO3
D.被氧化和被还原的N原子的物质的量之比为15:1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省等四校高三上学期期中联考化学试卷(解析版) 题型:选择题
.2014年1月14日晚21时45分,我国“玉兔号”月球车展开机械臂,对月球成功实施首次月面科学探测。月球的矿产资源极为丰富,仅月球表面5 cm厚的沙土就含有铁单质上亿吨,月球上的主要矿物有辉石(CaMgSi2O6)、斜长石(KAlSi3O8)等,下列说法或分析错误的是
A.CaMgSi2O6、KAlSi3O8是化学式,表示矿物的组成元素及其原子个数比
B.月球上有大量游离态铁是因为月球上铁的活动性比地球上弱
C.从辉石的组成来看,它可被看作为复盐
D.斜长石的氧化物形式可表示为:K2O·Al2O3·6SiO2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省高三上学期第二次月考化学试卷(解析版) 题型:实验题
(18分)
Ⅰ.无水氯化铝是有机化工常用催化剂,其外观为白色固体,178℃时升华,极易潮解,遇水后会发热并产生白雾。实验室用如下装置制备少量无水氯化铝,其反应原理为:2Al + 6HCl(g) = 2AlCl3 + 3H2
完成下列填空:
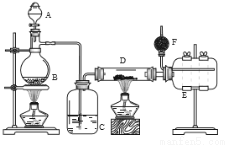
A为浓硫酸,B为NaCl固体
(1)进行实验时应先点燃 (选填“B”或“D”)处酒精灯。
(2)用粗短导管连接D、E的目的是________(选填序号)。
a.防堵塞 b.防倒吸 c.平衡气压 d.冷凝回流
(3)F中盛有碱石灰,其目的是 (选填序号)。
a.吸收多余HCl b.吸收Cl2
c.吸收CO2 d.防止空气中H2O进入E瓶
(4)将D中固体改为氯化铝晶体(AlCl3·6H2O)也能进行无水氯化铝的制备,此时通入HCl气体的目的是 。若实验条件控制不当,最终得到的物质是碱式氯化铝[化学式为Al2(OH)nCl(6-n)],且质量是原氯化铝晶体(AlCl3·6H2O)的40%,则可推算n的值为 。
Ⅱ.焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。Na2S2O5溶于水即生成NaHSO3。
(1)证明NaHSO3溶液中HSO3—的电离程度大于水解程度,可采用的实验方法是 (填序号)。
a.测定溶液的pH
b.加入Ba(OH)2溶液
c.加入盐酸
d.加入品红溶液
e.用蓝色石蕊试纸检测
(2)检验Na2S2O5晶体在空气中已被氧化的实验方案是________ ______。
(3)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量的方案如下:

(已知:滴定时反应的化学方程式为SO2 + I2 + 2 H2O = H2SO4 + 2 HI)
按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为 g/L。在上述实验过程中,若有部分HI被空气氧化,则测得结果 (填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省高三上学期第二次月考化学试卷(解析版) 题型:选择题
以下物质间的转化,不能通过一步反应实现的是
A.S→SO3→H2SO4 B.Al(OH)3→Al2O3→Al
C.Cu→CuCl2→Cu(OH)2 D.Na→Na2O2→Na2CO3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高三上学期期中化学试卷(解析版) 题型:选择题
已知电离平衡常数:H2CO3>HClO>HCO3—,下列有关叙述中,正确的是:
①若KI溶液中混有Br-,加入足量FeCl3溶液,用CCl4萃取后,取无色的水层并加入AgNO3溶液,有淡黄色沉淀生成。
②向FeI2溶液中滴加少量氯水,反应的离子方程式为:2Fe2++Cl2===2Fe3++2Cl-
③向NaClO溶液中通入少量二氧化碳的离子反应方程式:
2ClO-+CO2+H2O===2HClO+CO32—
④海水提溴过程中,用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,其离子方程式为
3 Br2+6 CO32-+3H2O=5 Br-+ BrO3-+6HCO3-
A.② ④ B.① ③ C.② ③ D.① ④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com