
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比($\frac{{P}_{后}}{{P}_{前}}$) | 0.98 | 0.90 | 0.78 | 0.66 | 0.66 | 0.66 |
 .
.
分析 (1)达到平衡后,体积不变时,能提高H2O的平衡转化率,应使平衡向正反应方向移动;
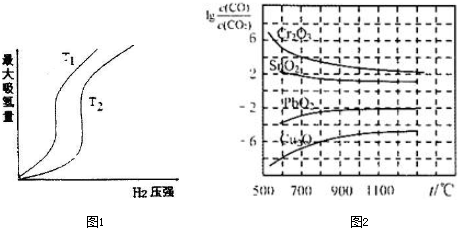
(2)在压强相同的条件下,T1对应的吸氢量大,也就是T2→T1,平衡正向移动,而正反应是放热反应;
(3)温度、体积不变的可逆反应中,气体的压强之比等于其物质的量之比,据此计算反应后气体体积的物质的量,从而计算氢气反应的物质的量,再根据v=$\frac{\frac{△n}{V}}{△t}$计算反应速率;根据CO反应的物质的量计算其转化率,化学反应速率概念计算v=$\frac{△c}{△t}$计算得到;转化率=$\frac{消耗量}{起始量}$×100%;
(4)K越大,说明反应进行的程度大,金属氧化物越易被还原;700℃时CO还原Cr2O3反应为:Cr2O3+3CO?2Cr+3CO2,lg($\frac{1}{K}$)${\;}^{\frac{1}{3}}$=4,所以K=10-12;
(5)①由图开始,实验Ⅱ与实验Ⅰ相比,反应速率加快,平衡时氮气的浓度不变,说明改变条件速率加快平衡不移动,结合反应特征与平衡移动原理分析;
②实验Ⅲ的温度比实验Ⅰ高,反应速率快,到达平衡时间缩短,正反应为放热反应,平衡向逆反应方向移动,平衡时氨气的浓度较实验Ⅰ低,据此作图;
(6)结合图象根据盖斯定律来计算反应的焓变.
解答 解:(1)达到平衡后,体积不变时,能提高H2O的平衡转化率,应使平衡向正反应方向移动,A.升高温度,平衡向吸热方向移动,故正确;
B.增加碳的用量,平衡都不移动,故错误;
C.加入催化剂,平衡都不移动,故错误;
D.用储氢金属吸收H2,减少生成物的浓度平衡正向移动,故正确;
故选AD;
(2)在压强相同的条件下,T1对应的吸氢量大,也就是T2→T1,平衡正向移动,而正反应是放热反应,所以T2→T1,是降温,所以T2>T1,故答案为:<;
(3)温度、体积不变的可逆反应中,气体的压强之比等于其物质的量之比,10min,压强比(P后/P前)=0.9,则反应后气体的物质的量=3mol×0.9=2.7mol,气体减少的物质的量=3mol-2.7mol=0.3mol,根据气体减少的物质的量与氢气之间的关系式知,参加反应的氢气的物质的量=$\frac{0.3}{2}×2$=0.3mol,0~10min,用H2表示的平均反应速率=$\frac{\frac{0.3}{2}}{10}$mol•L-1•min-1=0.015 mol•L-1•min-1;
平衡状态压强比(P后/P前)=0.66,则反应后气体的物质的量=3mol×0.66=1.98mol,气体减少的物质的量=3mol-1.98mol=1.02mol,根据气体减少的物质的量与氢气之间的关系式知参加反应的CO的物质的量$\frac{1.02mol}{2}$=0.51mol,则CO的转化率=$\frac{0.51mol}{1mol}$×100%=51%,
故答案为:0.015 mol•L-1•min-1;51%;
(4)K越大,金属氧化物越易被还原,故Cu2O越易被还原;700℃时CO还原Cr2O3反应为:Cr2O3+3CO?2Cr+3CO2,lg($\frac{1}{K}$)${\;}^{\frac{1}{3}}$=4,所以K=10-12,故答案为:①Cu2O;②10-12;
(5)①由图开始,实验Ⅱ与实验Ⅰ相比,反应速率加快,平衡时氮气的浓度不变,说明改变条件速率加快平衡不移动,该反应正反应是体积减小的放热反应,升高温度或增大压强、增大反应物浓度,可以增大反应速率,但平衡发生移动,故应是使用催化剂,
故答案为:使用催化剂;
②实验Ⅲ的温度比实验Ⅰ高,反应速率快,到达平衡时间缩短,正反应为放热反应,平衡向逆反应方向移动,平衡时氨气的浓度较实验Ⅰ低,故图象为: ,
,
故答案为: ;
;
(6)第一步的热化学方程式为NH4+(aq)+1.5O2(g)═NO2-(aq)+2H+(aq)+H2O(l),△H=-273KJ/mol,
第二步的热化学方程式为:NO2-(aq)+0.5O2(g)═NO3-(aq),△H=-73KJ/mol,
根据盖斯定律则NH4+(aq)+2O2(g)═2H+(aq)+H2O(l)+NO3-(aq),△H=-346 kJ/mol,
故答案为:NH4+(aq)+2O2(g)═2H+(aq)+H2O(l)+NO3-(aq),△H=-346 kJ/mol.
点评 题目综合性较大,涉及反应热计算、盖斯定律的应用、电极反应式书写、化学平衡的移动、化学平衡图象与影响因素、化学平衡常数计算等,侧重高考常考点与基础知识的考查,目难度较大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
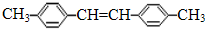 ;B的结构简式为
;B的结构简式为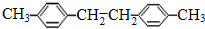 ;与A含有相同种类和数目的官能团(包括苯环)、且苯环上取代基位置和数量也相同的同分异构体有多种,写出其中任意一种的结构简式
;与A含有相同种类和数目的官能团(包括苯环)、且苯环上取代基位置和数量也相同的同分异构体有多种,写出其中任意一种的结构简式 (不包括原化合物,不考虑立体异构).
(不包括原化合物,不考虑立体异构).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2OH→CH3CHO | B. | Fe2O3→Fe(OH)3 | C. | SiO2→H2SiO3 | D. | Al2O3→Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 该反应中,热能转化为产物内部的能量 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 反应的热化学方程式为:NH4HCO3+HCl=NH4Cl+CO2↑+H2O△H=-Q kJ/mol(Q>0) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 80ml | B. | 120ml | C. | 150ml | D. | 200ml |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B |
| ①由C、H两种元素组成; ②能使溴的四氯化碳溶液褪色; ③比例模型为:  | ①由C、H两种元素组成; ②球棍模型为: 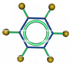 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第三周期第0族 | B. | 第三周期第ⅦA族 | C. | 第三周期第ⅠA族 | D. | 第ⅠA族第四周期 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com