
| A、能使甲基橙变黄的溶液中:Na+、K+、SO42-、AlO2- |
| B、水电离产生的c(H+)=1×10-12mol/L溶液:CH3COOH、Na+、Cl-、I- |
| C、能使pH试纸变深蓝色的溶液中:Na+、AlO2-、S2-、CO32- |
| D、0.1 mol?L-1NaHCO3溶液中:K+、Ba2+、OH-、Cl- |


科目:高中化学 来源: 题型:
| A、一个氮氮叁键形成的同时,有3个H-H键形成 |
| B、一个氮氮叁键断裂的同时,有3个H-H键断裂 |
| C、一个氮氮叁键断裂的同时,有6个N-H键断裂 |
| D、一个氮氮叁键断裂的同时,有6个N-H键形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质发生化学变化都伴随着能量变化 |
| B、任何反应中的能量变化都表现为热量变化 |
| C、同温同压下,H2(g)+Cl2(g)=2HCl(g) 在光照和点燃条件不同 |
| D、Ba(OH)2?8H2O与NH4Cl 的反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | |
| Y | Z |
| A、X的气态氢化物热稳定性强于Z的气态氢化物 |
| B、原子半径:X<Y<Z |
| C、若Y的最高正价为+m,则X,Z的最高正价一定为+(m+1) |
| D、Y和Z的最高价氧化物对应水化物酸性Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定符合 |
| B、一定不符合 |
| C、两种情况都有可能 |
| D、缺条件无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、属于置换反应 |
| B、还原性:H2O>H2S |
| C、氧化性:O2>S |
| D、酸性:H2S>H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
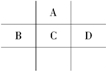 有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的氢氧化物是两性氢氧化物,E的阳离子与A的阴离子核外电子层结构相同.
有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的氢氧化物是两性氢氧化物,E的阳离子与A的阴离子核外电子层结构相同.查看答案和解析>>
科目:高中化学 来源: 题型:
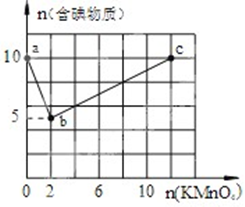 实验一:向含10mol KI的硫酸溶液中逐滴加入高锰酸钾溶液.整个过程中含碘物质与加入高锰酸钾的物质的量的关系如图,已知酸性条件下MnO4-转变为Mn2+.
实验一:向含10mol KI的硫酸溶液中逐滴加入高锰酸钾溶液.整个过程中含碘物质与加入高锰酸钾的物质的量的关系如图,已知酸性条件下MnO4-转变为Mn2+.查看答案和解析>>
科目:高中化学 来源: 题型:
| O2 |
| ① |
| O2 |
| ② |
| H2O |
| ③ |
| Cu |
| ④ |
| BaCl2 |
| ⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com