
某工厂用提取粗盐后的盐卤(主要成分为MgCl2)制备金属镁,其工艺流程如下,下列说法中错误的是
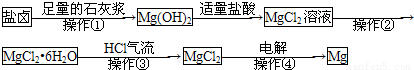
A.操作①——③是为了获得无水氯化镁
B.操作④发生了氧化还原反应
C.操作②是冷却结晶
D.若在实验室进行操作①只需要漏斗和烧杯两种玻璃仪器
科目:高中化学 来源:2016-2017学年江苏省高二12月月考化学卷(解析版) 题型:选择题
下列离子方程式正确的是
A.AgNO3溶液中加入过量的氨水:Ag++NH3·H2O=AgOH+NH4+
B.乙酸与碳酸钠溶液反应:2CH3COOH+CO32— CO2↑+H2O+2CH3COO—
CO2↑+H2O+2CH3COO—
C.苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O— 2C6H5OH+2CO32—
2C6H5OH+2CO32—
D.用铜作电极电解氯化铜溶液:Cu2++2Cl— Cu+Cl2↑
Cu+Cl2↑
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一12月月考化学卷(解析版) 题型:选择题
某混合物的水溶液中可能含有以下离子:Na+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、SO42-,现取100mL的两份溶液进行如下实验。(己知NH4++OH-=NH3↑+H2O)
① 一份加过量NaOH溶液后加热,收集到0.03mol气体,无沉淀生成,同时得到溶液甲。
② 向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧后,得到1.02g固体。
③ 另一份加足量BaCl2溶液后,生成白色沉淀,过滤后的沉淀经量盐酸酸洗涤、干燥后,得到23.3g固体,向滤液中加入AgNO3溶液又有白色沉淀产生。
下列有关叙述正确的是( )
A.由①可知原溶滚存在离子为NH4+,其浓度为0.03mol/L
B.n(NH4+):n(Al3+):n(SO42-)=3:l:10
C.原溶液一定存在Cl-
D.原溶液肯定没有Fe3+、Mg2+,一定含有Na+
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一12月月考化学卷(解析版) 题型:选择题
某国外化学教材中有一张关于氧化还原反应的插图。由图可知.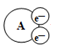 在该反应中是
在该反应中是
A.氧化产物 B.还原产物 C.氧化剂 D.还原剂
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高一上期中化学卷(解析版) 题型:填空题
①VLFe2(SO4)3中含有Fe3+mg,则SO42-的物质的量浓度为____________
②6.02×1024个Na+约含_______molNa+;4.5mol甲烷约含有_________个分子,其质量为________g;
3.01×1023个CO2在标准状况下体积是________L,它与__________gCO含有相同的氧原子数。
③将4ml37%的盐酸密度为(1.19g·cm-3)加水稀释到200ml,稀释后盐酸的物质的量浓度是__________。
④在标准状况下22.4L由氮气和氧气组成给的混合气体,其质量为30g,则其中氧气的质量为__________g。
⑤同温同压下,同体积的H2和A气体的质量分别为1.0g和16.0g,则A的相对体积分子质量为__________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高一上期中化学卷(解析版) 题型:选择题
下列说法正确的是
A.金属在反应中只能作还原剂,非金属在反应中只能作氧化剂
B.氧化剂在反应中失去电子,还原剂在反应中得到电子
C.氧化剂具有氧化性,还原剂具有还原性
D.阳离子只有氧化性,阴离子只有还原性
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高一上期中化学卷(解析版) 题型:选择题
下列关于胶体的叙述中,错误的是
A.胶体的本质特征是其分散质粒子直径为1-100nm
B.胶体是胶状的纯净化合物
C.利用丁达尔效应可区分溶液和胶体
D.将饱和FeCl3溶液滴入沸水中,再煮沸可形成红褐色的胶体
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高一上月考三化学卷(解析版) 题型:选择题
将某份铁铝合金样品均分为两份,一份加入足量盐酸,另一份加入足量 NaOH 溶液,同温同压下产生的气体体积比为3 : 2 ,则样品中铁、铝物质的量之比为( )
A.3 : 2 B.2 : 1 C.3 : 4 D.4 : 3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省四地六校高一上学期12月月考化学试卷(解析版) 题型:实验题
(1)过氧化钠保存不当容易变质,生成Na2CO3。判断过氧化钠在空气中是否变质的简单方法是观察颜色是否 。
(2)某过氧化钠样品已经部分变质,可以取少量样品,溶解,加入 溶液,充分振荡,看是否有白色沉淀,通过判断溶液中含有碳酸根来证明Na2O2已经变质
(3)检验样品中还有过氧化钠的方法是:取少量样品放入试管中,再加入适量的水,用 ,通过验证反应产生了氧气来证明样品中仍有Na2O2
(4)某课外活动小组为了粗略测定过氧化钠的质量分数,他们称取ag样品,并设计用下图装置来测定过氧化钠的质量分数。
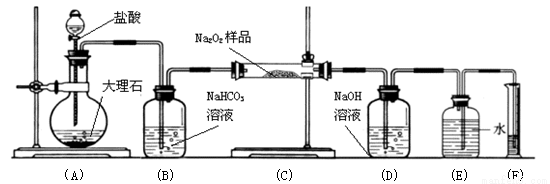
上图中的E和F构成量气装置,用来测定O2的体积。
写出装置A中发生反应的离子方程式:
装置B 的作用是除去混在二氧化碳中的氯化氢气体,
的作用是除去混在二氧化碳中的氯化氢气体,
NaOH的作用是
他们在读出量筒内水的体积数后,折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com