
| A. | ①②④ | B. | ②③⑥ | C. | ④⑤⑥ | D. | ③⑤⑥ |
分析 ①过量的二氧化硫与氢氧化钙反应最终生成可溶性亚硫酸氢钙溶液;
②亚硫酸的酸性弱于盐酸;
③二氧化硫与碳酸钠反应生成亚硫酸氢钠溶液和二氧化碳;
④亚硫酸酸性强于硅酸;
⑤过量的SO2气体通入Ba(NO3)2溶液中,发生氧化还原反应生成硫酸钡沉淀;
⑥可生成苯酚,苯酚难溶于水.
解答 解:①过量的二氧化硫与氢氧化钙反应最终生成可溶性亚硫酸氢钙溶液,不会产生沉淀;
②亚硫酸的酸性弱于盐酸,不反应,不会产生沉淀;
③二氧化硫与碳酸钠反应生成亚硫酸氢钠溶液和二氧化碳,不会产生沉淀;
④亚硫酸酸性强于硅酸,产生白色的硅酸沉淀;
⑤过量的SO2气体通入Ba(NO3)2溶液中,发生氧化还原反应生成硫酸钡沉淀;
⑥亚硫酸酸性比苯酚强,可生成苯酚,苯酚难溶于水,可生成沉淀,
则生成沉淀的有④⑤⑥,
故选C.
点评 本题考查了二氧化硫的化学性质,为高频考点,侧重二氧化硫酸性氧化物及还原性的考查,注意硝酸根离子在酸性环境下的强氧化性,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | M g | B. | $\frac{1}{M}$ g | C. | $\frac{M}{6.02×1{0}^{23}}$ g | D. | $\frac{6.02×1{0}^{23}}{M}$g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | 丙 | |
| A | Al | H2SO4 | KOH |
| B | Na2O2 | CO2 | H2O |
| C | Na2CO3 | CH3COOH | Ca(OH)2 |
| D | FeO | HNO3 | Cl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol<n≤2 mol | B. | 1 mol<n≤4 mol | C. | 2 mol<n≤4 mol | D. | n>4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 把在空气中久置的镁条7.2g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,镁条与硫酸反应产生氢气的速率与反应时间如图所示,回答下列问题:
把在空气中久置的镁条7.2g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,镁条与硫酸反应产生氢气的速率与反应时间如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
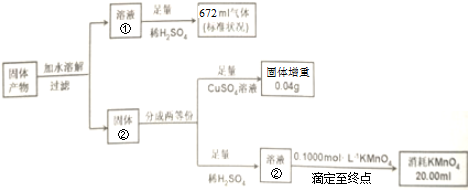
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na4S2O3 | B. | CaOCl2 | C. | KAl(SO4)2 | D. | Ca(NO3)Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、SiO2、P2O5均为酸性氧化物 | |
| B. | 是否具有丁达尔效应是胶体与溶液、浊液的根本区别 | |
| C. | 纯净盐酸为纯净物、冰水混合物为混合物 | |
| D. | 烧碱、纯碱都属于碱,油脂、甘油都属于酯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com