
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是
A.H2SO4的摩尔质量是98g
B.1mol O2的体积是22.4L
C.18g H2O含有的原子总数为3NA
D.0.1 mol·L-1 BaCl2溶液中,Cl-的物质的量浓度为0.1 mol·L-1
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:
【题目】如右表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法不正确的是( )
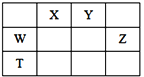
A. X、Y、Z三种元素最低价氢化物的沸点依次升高
B. 由X、Y和氢三种元素形成的化合物中有共价键
C. 物质WY2、W3X4均有熔点高、硬度大的特性
D. T元素肯定是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组的同学用右图所示的实验装置进行电解反应,电解槽内装有KI-淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。

已知:3I2+6OH-= IO3-+5I-+3H2O
回答下列问题:
(1)左侧为电源__________极。(填“正”或“负”)
(2)请用方程式及必要的文字解释左侧溶液变蓝色的原因?___________________。
(3)写出右侧发生的有关电极反应的反应式:_____________________。
(4)电解反应结束时,左侧溶液中还_________I-。(填“有”或“没有”)
(5)写出电解槽内发生反应的总化学方程式:_____________________。
(6)如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学反应_________。(填“变”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用洗净的废铜屑作原料来制备硝酸铜.下列设计路线符合“绿色化学”思想的是( )
A.Cu+HNO3(浓)→Cu(NO3)2
B.Cu+HNO3(稀)→Cu(NO3)2
C.Cu![]() CuO
CuO![]() Cu(NO3)2
Cu(NO3)2
D.Cu![]() CuSO4
CuSO4![]() Cu(NO3)2
Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知在碱性溶液中可发生如下反应:2R(OH)3+3C1O-+4OH- =2RO4n-+3Cl-+5H2O。则RO4n-中R的化合价是( )
A. +2 B. +4 C. +6 D. +7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关过滤和蒸发的操作中,正确的是( )
A.过滤时,漏斗的下端管口紧靠烧杯内壁
B.为了加快过滤速度,可用玻璃棒搅动过滤器中的液体
C.当蒸发皿中的固体完全蒸干后,再停止加热
D.实验完毕后,用手直接取走蒸发皿
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲配制6.0mol/L的H2SO41000mL,实验室有三种不同浓度的硫酸:①480mL 0.5mol/L 的硫酸;②150mL 25%的硫酸(ρ=1.18g/mL);③足量的18mol/L的硫酸.有三种规格的容量瓶:250mL、500mL、1000mL.老师要求把①②两种硫酸全部用完,不足的部分由③来补充.请回答下列问题:
(1)实验所用25%的硫酸的物质的量浓度为 mol/L(保留1位小数).
(2)配制该硫酸溶液应选用容量瓶的规格为 mL.
(3)配制时,该同学的操作顺序如下,请将操作步骤B、D补充完整.
A.将①②两溶液全部在烧杯中混合均匀;
B.用量筒准确量取所需的18mol/L的浓硫酸 mL,沿玻璃棒倒入上述混合液中.并用玻璃棒搅拌,使其混合均匀;
C.将混合均匀的硫酸沿玻璃棒注入所选的容量瓶中;
D. ;
E.振荡,继续向容量瓶中加水,直到液面接近刻度线1~2cm 处;
F.改用胶头滴管加水,使溶液的凹液面恰好与刻度线相切;
G.将容量瓶盖紧,振荡,摇匀.
(4)定容时俯视刻度线,会使所配溶液浓度 (填“偏大”、“偏小”或“无影响”).
(5)进行操作C前还需注意 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
元 素 | Mn | Fe | |
电离能 | I1 | 717[ | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
回答下列问题:
(1) Mn元素价电子层的电子排布式为 ,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。对此,你的解释是 ;
(2) Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。
① 与Fe原子或离子形成配合物的分子或离子应具备的结构特征是 ;
② 六氰合亚铁离子(Fe(CN)64-)中的配体CN-中C原子的杂化轨道类型是 ,写出一种与CN-互为等电子体的单质分子的路易斯结构式 ;
(3) 三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为 ;
(4) 金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示。面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com