
下列离子方程式正确的是( )
|
| A. | 石灰水与过量碳酸氢钠溶液反应:HCO |
|
| B. | 向沸水中滴加饱和的FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O |
|
| C. | 氧化铜与稀硫酸反应:2H++O2﹣═H2O |
|
| D. | 碳酸氢钠溶液中加入盐酸:CO |
考点:
离子方程式的书写.
专题:
离子反应专题.
分析:
A.碳酸氢钠过量,氢氧化钙不足,离子方程式按照氢氧化钙的组成书写;
B.铁离子在沸水中水解生成氢氧化铁胶体;
C.氧化铜不能拆开,在离子方程式中应该保留化学式;
D.碳酸氢根离子不能拆开,应该写成碳酸氢根离子形式.
解答:
解:A.石灰水与过量碳酸氢钠溶液反应,氢氧化钙不足,反应离子方程式按照氢氧化钙的组成书写,正确的离子方程式为:2HCO3﹣+Ca2++2OH﹣═CaCO3↓+CO32﹣+2H2O,故A错误;
B.向沸水中滴加饱和的FeCl3溶液制备Fe(OH)3胶体,反应的离子方程式为:Fe3++3H2O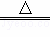 Fe(OH)3(胶体)+3H+,故B正确;
Fe(OH)3(胶体)+3H+,故B正确;
C.氧化铜与稀硫酸反应,氧化铜应该保留化学式,正确的离子方程式为:2H++CuO═H2O+Cu2+,故C错误;
D.碳酸氢根离子不能拆开,正确的离子方程式为:HCO3﹣+H+═CO2↑+H2O,故D错误;
故选B.
点评:
本题考查了离子方程式的书写判断,题目难度中等,注意掌握离子方程式的书写原则,明确常见的需要保留化学式的物质,如弱电解质、氧化物等,选项A为易错点,注意反应物的过量情况.


科目:高中化学 来源: 题型:
为达到相应的实验目的,下列实验的设计或操作最合理的是( )
A. 为测定一定浓度的NaOH溶液放置空气中是否部分转化为Na2CO3,用酚酞作指示剂,用标准盐酸溶液滴定
B. 为观察Mg条在CO2气体中的燃烧,在一个集气瓶中收集满CO2气体,取一小段除去表面氧化膜的Mg条用坩埚钳夹持点燃后迅速投入上述集气瓶底部
C. 为比较Cl与S元素的非金属性强弱,相同条件下,测定相同浓度的NaCl溶液和Na2S溶液的pH值
D. 给盛有铜与浓硫酸的试管加热,发现试管底部出现灰白色固体,为检验其中的白色固体为无水硫酸铜,可直接向试管中加入适量水
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,既有共价键的断裂,又有离子键的形成的是( )
|
| A. | 盐酸和氢氧化钠溶液反应 |
|
| B. | 氯化氢气体溶解于水 |
|
| C. | 氯化氢气体遇到氨气产生“白烟” |
|
| D. | 锌片投入稀硫酸中产生气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W、E为前四周期五种元素,分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X、Y、Z的氢化物都比同族元素氢化物的沸点高.E原子外围未成对电子数是同周期中最多的.W元素的电离能数据见下表(kJ•mol﹣1):
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
请回答:
(1)E元素基态原子的价电子排布式是: ,周期表中位置 ;
(2)X、Y、Z、W四种元素的电负性大小关系: (填元素符号,用“>”连接);
(3)写出W2Y2的电子式 ;
(4)X、Z可以形成一种共价化合物,其中两种元素最外层电子数都达到8,则其分子的空间构型是: ;
(5)X的氢化物易溶于水的原因是:
(6)用氢键表示式写出Z的氢化物水溶液中可能存在的氢键 .
(7)肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)═3N2(g)+4H2O(g)
若该反应中有4mol N﹣H键断裂,则形成的π键有 mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,正确的是( )
|
| A. | CO2的摩尔质量为44 g |
|
| B. | 1 mol N2的质量是14 g |
|
| C. | 等质量的水与质量分数98%L的硫酸混合所得溶液的质量分数大于49% |
|
| D. | 标准状况下,1 mol CO2所占的体积约是22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,PbO2与Cr3+反应,产物是Cr2O72﹣和Pb2+,则1mol Cr3+反应所需PbO2的物质的量是( )
|
| A. | 3.0 mol | B. | 1.5 mol | C. | 1.0 mol | D. | 0.75 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
有一固体混合物,可能由Na2CO3、CaCO3、Na2SO4、CuSO4、CaCl2、NaCl等混合组成.为检验它们,做了以下实验:
(1)将固体混合物溶于水,搅拌后得无色透明溶液;
(2)往此溶液中滴加过量的硝酸钡溶液,有白色沉淀生成;
(3)过滤,将沉淀物置于稀硝酸中,发现沉淀部分溶解.
试判断:
①固体混合物中肯定有 ,
②肯定没有 ,
③可能有 N ;
对可能有的物质,可采取向滤液中滴加 溶液的方法来检验.
查看答案和解析>>
科目:高中化学 来源: 题型:
除去下列物质中所含少量杂质(括号中为杂质),所选用的试剂和分离方法能达到实验目的是( )
| 混合物 | 试剂(足量) | 分离方法 | |
| A | 苯(苯酚) | 浓溴水 | 过滤 |
| B | 乙烷(乙烯) | 酸性KMnO4溶液 | 洗气 |
| C | 乙酸乙酯(乙酸) | 饱和Na2CO3溶液 | 分液 |
| D | 乙酸(乙醛) | 新制Cu(OH)2 | 过滤 |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
Al2O3、Al(OH)3都是重要化工原料。根据要求回答问题:
Ⅰ.电解法制高品质Al(OH)3装置如下(中间用离子交换膜隔开):
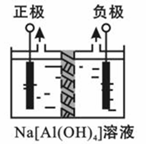
4Na[Al(OH)4]+2H2O 4Al(OH)3↓+4NaOH+O2↑+2H2↑
4Al(OH)3↓+4NaOH+O2↑+2H2↑
(1)产物Al(OH)3在 区(填“阴极”或“阳极”)沉积;
(2)电解中转移2mol e-时,将制得__________mol的Al(OH)3。
Ⅱ.制取纳米Al2O3需要纯净的硫酸铝。现有0.05mol·L-1硫酸铝溶液,经检测,含有Fe2+、Fe3+。可按下述操作提纯:往溶液中加足量H2O2充分反应,再用试剂X调节溶液pH=3.5。(室温下,0.1mol·L-1的Fe2+、Al3+开始沉淀的pH分别为7.0和3.7,Fe3+完全沉淀的pH=3.2)
(3)纳米氧化铝分散在分散剂中将形成胶体。则纳米氧化铝的直径约为_________m。
(4)检验硫酸铝溶液含有Fe3+时,所采用的试剂及现象是____________________。
(5)往溶液中加入H2O2的作用是 (用离子方程式表示)。
(6)加入的X试剂(填选项编号)是 。
A.CuO B.Al(OH)3 C.NaOH D.NaHCO3
若调节后溶液的pH偏离3.5,可能带来的后果是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com