
【题目】t℃时,CuSO4在水中溶解度为25g,将32gCuSO4白色粉末加入到mg水中,形成饱和CuSO4溶液,并有CuSO4·5H2O晶体析出,则m的取值范围是
A. 18g≤m≤128g B. 36g<m<180g
C. 18g<m<128g D. 36g<m≤180g
科目:高中化学 来源: 题型:
【题目】高铁酸钾是绿色、环保型水处理剂,也是高能电池的电极材料。工业上,利用硫酸亚铁为原料,通过铁黄(FeOOH)制备高铁酸钾,可降低生产成本且产品质量优。工艺流程如下:
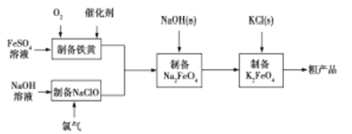
回答下列问题:
(1)有同学认为上述流程可以与氯碱工业联合。写出电解饱和食盐水制取次氯酸钠的化学方程式 。
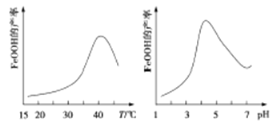
(2)制备铁黄的反应中氧化剂与还原剂的物质的量之比为 。实验测得反应溶液的pH、温度对铁黄产率的影响如图所示。反应温度宜选择 ;pH大于4.5时铁黄产率降低的主要原因可能是 。
(3)用高铁酸钾处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3、CN-等,生成的氢氧化铁胶体粒子还能吸附水中悬浮杂质。试写出高铁酸钾处理含CN-废水时除去CN-的离子方程式 。
(4)K2FeO4可作锌铁碱性高能电池的正极材料,电池反应原理:
2K2FeO4+3Zn+8H2O![]() 2Fe(OH)3+3Zn(OH)2+4KOH。放电时负极材料是 ;充电时阳极的电极反应式为 。
2Fe(OH)3+3Zn(OH)2+4KOH。放电时负极材料是 ;充电时阳极的电极反应式为 。
(5)已知:常温下,Kap[Fe(OH)3]=4.0×10-38。高铁酸钾的净水能力与废水的pH有关,当溶液pH=2时,废水中c(Fe3+)= mol·L-1。
(6)如果上述流程中,铁元素总利用率为75%。利用1mol 2mol·L-1FeSO4溶液能制备纯度为90%的高铁酸钾 kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于元素周期表的_________区;溴的价电子排布式为________________。
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是________。
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是_________(写出名称)。
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图I、II所示:
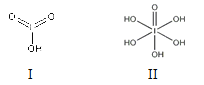
请比较二者酸性强弱:HIO3________H5IO6(填“>”、 “<”或“=”)。
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为___________,写出一个ClO2-的等电子体__________。
(6)右图为碘晶体晶胞结构。有关说法中正确的是_________。
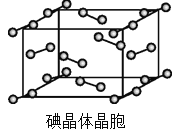
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(见右图)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________。
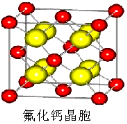
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】给出下列氧化还原反应,试回答下列问题。
(1)KMnO4+ KI+ H2SO4 K2SO4+ MnSO4 + I2十 H2O
配平化学反应方程式 被还原的元素 ,发生氧化反应的物质 。
(2)3Cl2 + 6NaOH![]() 5NaCl + NaClO3 + 3H2O
5NaCl + NaClO3 + 3H2O
用双线桥标出电子转移的方向和数目 氧化剂与还原剂的物质的量之比为 ,氧化产物是 。
(3)11P+15CuSO4+24H2O=6H3PO4+15H2SO4+5Cu3P(反应中Cu3P中的P为负三价)。
该反应中Cu2+表现 性(填氧化或还原);11molP中被P氧化的P是 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物中一个碳原子上连有两个羟基时,易脱水形成碳氧双键;物质A~F有如下转化关系:

试回答下列问题:
(1)E中含有的官能团的名称是________,C跟新制的氢氧化铜悬浊液反应的化学方程式为________。
(2)A与NaOH溶液共热时反应的化学方程式为________。
(3)已知B的相对分子质量为162,其燃烧产物中n(CO2)∶n(H2O)=2∶1。则B的分子式为________。
(4)F具有如下特点:①能跟FeCl3溶液发生显色反应;②能发生加聚反应。若F苯环上的一氯代物只有两种,F在一定条件下发生加聚反应的化学方程式为________。
(5)化合物G是F的同分异构体,它属于芳香族化合物,能发生银镜反应。则G可能有________种结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2、SO2均能使品红溶液褪色。后者因为品红分子结构中的发色团遇到亚硫酸后结构发生改变,生成不稳定的无色化合物。其漂白原理可用下面的反应方程式表示:
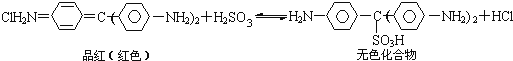
下列说法正确的是
A.品红溶液中同时通入Cl2、SO2,漂白效果会更好
B.加热不能判断品红褪色是通入SO2还是通入Cl2引起的
C.“无色化合物”分子中,19个碳原子都可能在同一平面上
D.品红分子结构中,19个碳原子都可能在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。
请回答下列问题:
(1)X元素原子基态时的电子排布式为______________,该元素的符号是________;
(2)Y元素原子的价层电子的电子排布图为____________________,该元素的名称是________;
(3)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是_________________________________________________;
(4)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性,并说明理由_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组设计的实验室制取乙酸乙酯的装置如下图所示。下列说法错误的是
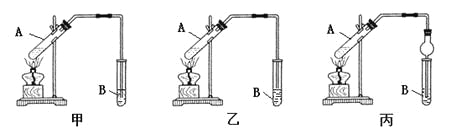
A. 上述实验装置正确且能顺利完成实验的是乙和丙
B. 试管B内盛放的液体是NaOH溶液
C. 在试管A中应加几块碎瓷片以防止A中的液体加热时发生暴沸
D. 反应结束后振荡试管B,B中液体分为两层,上层为无色油状液体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com