
| A、强电解质溶液的导电性不一定强于弱电解质溶液的导电性 |
| B、电解质溶液中阳离子所带正电荷总数等于阴离子所带负电荷总数 |
| C、易溶物是强电解质,难溶物一定是弱电解质 |
| D、硫酸钡在水里的溶解度很小,但溶于水的硫酸钡全部电离,所以硫酸钡是强电解质 |


科目:高中化学 来源: 题型:
| A、室温下,28 g N2所含的分子数多于NA |
| B、标况下,16 g O2所含原子数是NA |
| C、电子数是NA的NH3的物质的量是1 mol |
| D、17 g OH-中质子总数比电子总数多NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
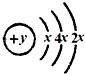 ;F的最外层电子数是电子层数的2倍.
;F的最外层电子数是电子层数的2倍.查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X原子的L层电子数是K层电子数的2倍 |
| Y | Y的单质存在Y2、Y3两种同素异形体 |
| Z | Z存在质量数为23,中子数为12的原子核 |
| W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在pH=1的溶液中:K+、Na+、SO42-、HCO3- | ||
B、在
| ||
| C、在0.1 mol?L-1 FeCl3溶液中:K+、NH4+、I-、SCN- | ||
| D、在0.1 mol?L-1 Na2CO3溶液中:Al3+、K+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、未用标准液润洗用蒸馏水洗过的碱式滴定管 |
| B、达到滴定终点,读数时俯视滴定管的刻度 |
| C、滴定过程中振荡锥形瓶有少许盐酸溅出 |
| D、盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com