
 △H=+124kJ•mol-1
△H=+124kJ•mol-1| 化学键 | C-H | C-C | C═C | H-H |
| 键能/kJ•mol-1 | 412 | 348 | x | 436 |
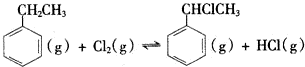 △H2>0
△H2>0
分析 (1)依据反应热=反应物总键能-生成物总能键能计算解答;
(2)保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向气体体积增大的方向移动;
(3)反应自发进行的判断依据是△H-T△S<0;
(4)①图象分析可知,达到平衡状态HCl生成浓度为0.16mol/L,反应速率v=$\frac{△c}{△t}$;
②T°C达到平衡状态,c(HCl)=0.16mol/L,c(Cl2)=0.04mol/L,结合化学平衡三行计算列式计算得到平衡浓度,平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
③6min后HCl浓度增大,氯气浓度减小,说明平衡正向进行,曲线变陡说明反应速率加快,改变的条件可以是升温;
④先计算平衡状态下物质的浓度,再向容器中充人1moI乙苯、1mol Cl2、1mol α-氯乙基苯和l mol HCl,计算此时浓度商和平衡常数比较判断反应进行的方向,利用平衡常数计算得到锌平衡状态下HCl和Cl2的平衡浓度,据此绘制变化图象,
解答 解:(1)反应热=反应物总键能-生成物总能键能,由有机物的结构可知,应是-CH2CH3中总键能与-CH=CH2、H2总键能之差,设C=C键能为X,则△H=(5×412+348-3×412-X-436)kJ•mol-1=124kJ•mol-1,解得X=612KJ/mol;
故答案为:612;
(2)正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动;
故答案为:正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动,提高乙苯的平衡转化率;
(3) △H=+124kJ•mol-1,反应为气体体积增大的吸热反应,△H>0,△S>0,满足△H-T△S<0,需要高温条件下,
△H=+124kJ•mol-1,反应为气体体积增大的吸热反应,△H>0,△S>0,满足△H-T△S<0,需要高温条件下,
故答案为:高温;
(4)①T℃时,向10L恒容密闭容器中充人2mol乙苯(g)和2mol Cl2(g)发生反应Ⅱ,5min时达到平衡,依据题干条件可知,C(HCl)=0.16mol/L,v=$\frac{\frac{△n}{V}}{△t}$=$\frac{0.16mol/L}{5min}$=0.032 mol•L-1•min-1,
故答案为:0.032 mol•L-1•min-1;
②5min时达到平衡,依据题干条件可知,C(HCl)=0.16mol/L,n(HCl)=1.6mol,
起始(mol) 2 2 0 0
转化(mol) 1.6 1.6 1.6 1.6
平衡(mol) 0.4 0.4 1.6 1.6
平衡常数为K=$\frac{\frac{1.6}{10}×\frac{1.6}{10}}{\frac{0.4}{10}×\frac{0.4}{10}}$=16,
故答案为:16;
③制备α-氯乙基苯的正反应为吸热反应,反应前后气体的体积不变,6min时,乙苯、Cl2的浓度在减小,而α-氯乙基苯和HCl的浓度在增加,反应向正反应方向移动,只能是升高温度,
故答案为:升高温度;
④10min时,乙苯、Cl2、α-氯乙基苯和 HCl的物质的量浓度分别为:0.02mol/L、0.02mol/L、0.18mol/L、0.18mol/L,平衡常数为K=$\frac{0.18×0.18}{0.02×0.02}$=81,此时乙苯、Cl2、α-氯乙基苯和 HCl的物质的量浓度比为:1:1:9:9,保持其他条件不变,再向容器中充人1mol 乙苯、1mol Cl2、1mol α-氯乙基苯和l mol HCl,相当于增加反应物的浓度,平衡正向移动,则α1<α2,设转化的乙苯物质的量浓度为x,则

起始(mol/L) 0.12 0.12 0.28 0.28
转化(mol/L) x x x x
平衡(mol/L) 0.12-x 0.12-x 0.28+x 0.28+x
平衡常数为K=$\frac{(0.28+x)(0.28+x)}{(0.12-x)(0.12-x)}$=81,解得x=0.08mol/L,则12min时,乙苯、Cl2物质的量浓度都为0.12-x=0.04mol/L,α-氯乙基苯和 HCl的物质的量浓度都为:0.28+x=0.36mol/L,浓度变化曲线如图: ,
,
故答案为: ;<.
;<.
点评 本题考查了反应热的计算、化学平衡理论,明确应热=反应物总键能-生成物总能键能,熟悉影响化学平衡移动的因素是解题关键,注意(4)利用平衡常数不变,利用三段式计算并画图是该题的难点,题目难度中等.


科目:高中化学 来源: 题型:解答题
 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对燃烧煤时产生的尾气进行除硫处理 | |
| B. | 往已经酸化的土壤撒石灰中和 | |
| C. | 煤燃烧时鼓入足量空气 | |
| D. | 将煤除硫后再燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol•L-1 | 5.00 | 3.50 | 2.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| m | α | y |
| 1 | 0.25 | 16.67% |
| 2 | 0.45 | |
| 3 | 0.56 | 19.35% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q | |
| B. | 若温度不变,压强增大到原来的2倍,达到新平衡时,总体积一定比原来的$\frac{1}{2}$要小 | |
| C. | 若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a | |
| D. | 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com