

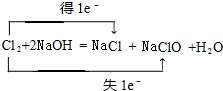 ;
;
分析 (1)(2)(3)向NaOH溶液中通入Cl2,发生的反应为Cl2+2NaOH=NaCl+NaClO+H2O,然后向溶液中加入Fe(NO3)3,发生的反应为3NaClO+2 Fe(NO3)3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O,向溶液中加入HCl来调节溶液的pH,然后过滤得到NaCl,向滤液中加入饱和KOH,利用溶解度不同,发生反应:Na2FeO4+2KOH=K2FeO4+2NaOH,过滤得到粗的K2FeO4,通过提纯得到纯的K2FeO4.
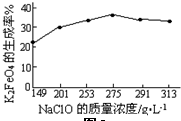
(4)由图可知,NaClO在275g/L时,K2FeO4的生成率最高,进而计算其物质的量浓度;
(5)K2FeO4 在水溶液中易水解,应选择非水溶液抑制K2FeO4水解,进行洗涤.
解答 解:向NaOH溶液中通入Cl2,发生的反应为Cl2+2NaOH=NaCl+NaClO+H2O,然后向溶液中加入Fe(NO3)3,发生的反应为3NaClO+2 Fe(NO3)3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O,向溶液中加入HCl来调节溶液的pH,然后过滤得到NaCl,向滤液中加入饱和KOH,利用溶解度不同,发生反应:Na2FeO4+2KOH=K2FeO4+2NaOH,过滤得到粗的K2FeO4,通过提纯得到纯的K2FeO4,
(1)反应①的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,标出电子转移数目与方向为: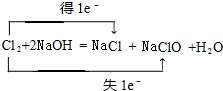 ,
,
故答案为: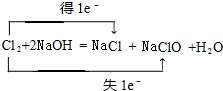 ;
;
(2)反应器中发生的反应为:3NaClO+2 Fe(NO3)3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O,离子方程式为:2Fe3++3ClO-+10OH-═2FeO42-+3Cl-+5H2O
故答案为:2;3;10;2;3;5;H2O;
(3)转化过程利用溶解度不同,由Na2FeO4转化为K2FeO4,反应方程式为:Na2FeO4+2KOH=K2FeO4+2NaOH,
故答案为:Na2FeO4+2KOH=K2FeO4+2NaOH;
(4)由图可知,NaClO在275g/L时,K2FeO4的生成率最高,NaClO的物质的量浓度为$\frac{\frac{275g}{74.5g/mol}}{1L}$=3.7mol/L,
故答案为:3.7mol/L,
(5)操作①是分离互不相溶的固体与液态,应采取过滤操作,K2FeO4 在水溶液中易水解,选择异丙醇洗涤可以抑制K2FeO4水解,
故答案为:过滤;K2FeO4 在水溶液中易水解,选择异丙醇洗涤可以抑制K2FeO4水解.
点评 本题考查学生对工艺流程的理解、对操作的评价分析、物质的分离提纯、氧化还原反应等,需要学生具有扎实的基础知识及灵活运用知识解决问题的能力,难度中等.


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 32gO2所含的氧原子数目为NA | |
| B. | 标准状况下,22.4L水中所含的水分子数目为NA | |
| C. | 1mol•L-1Na2SO4溶液中含有的钠离子数目为2NA | |
| D. | 1molMg变为Mg2+时失去电子的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某研究小组探究:
某研究小组探究:查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Na<Mg<Al | B. | 热稳定性:HCl>HBr>HI | ||
| C. | 酸性强弱:H2SiO3<H2CO3<H2SO4 | D. | 熔点:SiO2>NaCl>CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
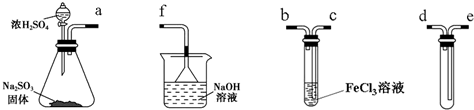
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
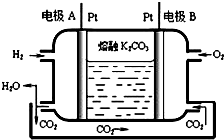 运用所学化学原理,解决下列问题:
运用所学化学原理,解决下列问题:| 温度/ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
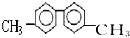
| A. | 该烃分子中最多有6个碳原子处于同一直线上 | |
| B. | 该烃分子中至少有10个碳原子处于同一平面上 | |
| C. | 该烃的一氯代物最多有四种 | |
| D. | 该烃是苯的同系物,能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com