
| A. | 加5 mL水,c (H+)增大 | B. | 加少量NaCl固体,c (H+)不变 | ||
| C. | 加少量碳酸钙粉末,c(HClO)升高 | D. | 加少量Na2SO3固体,溶液pH升高 |
分析 A、加入5mL水,化学平衡右移,溶液中的氢离子的物质的量增大;
B、加入少量的氯化钠固体,c(Cl-)增大;
C、加少量碳酸钙粉末,和H+反应,导致c(H+)减小;
D、加少量Na2SO3固体,能和HClO反应.
解答 解:A、加入5mL水,化学平衡右移,溶液中的氢离子的物质的量增大,但由于溶液体积增大,故c(H+)减小,故A错误;
B、加入少量的氯化钠固体,c(Cl-)增大,导致平衡左移,则c(H+)减小,故B错误;
C、加少量碳酸钙粉末,和H+反应,导致c(H+)减小,平衡右移,c(HClO)升高,故C正确;
D、加少量Na2SO3固体,能和HClO发生氧化还原反应导致HClO浓度降低,平衡右移,氢离子浓度增大,则pH减小,故D错误.
故选C.
点评 本题考查了影响化学平衡的因素,难度不大,应注意的是加入的物质对离子浓度的影响,较易出错的是D,Na2SO3固体,能和HClO发生氧化还原反应导致HClO浓度降低.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:选择题
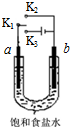 用如图装置研究电化学原理,下列分析中错误的是( )
用如图装置研究电化学原理,下列分析中错误的是( )| 选项 | 连接 | 电极材料 | 分析 | |
| a | b | |||
| A | K1 K2 | 石墨 | 铁 | 模拟铁的吸氧腐蚀 |
| B | K1 K2 | 锌 | 铁 | 模拟钢铁防护中牺牲阳极的阴极保护法 |
| C | K1 K3 | 石墨 | 铁 | 模拟电解饱和食盐水 |
| D | K1 K3 | 铁 | 石墨 | 模拟钢铁防护中外加电流的阴极保护法 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
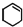 )为原料合成,路线如下(部分反应条件略):
)为原料合成,路线如下(部分反应条件略):



 .
. .
.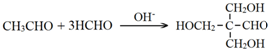 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
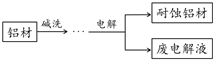 铝自然形成的氧化膜易脱落.以硫酸为电解液,分别以石墨和铝材做阴、阳极材料,经过电解处理形成的氧化铝膜,抗蚀能力强.其制备的简要流程如图.下列用来解释流程中反应的方程式不正确的是( )
铝自然形成的氧化膜易脱落.以硫酸为电解液,分别以石墨和铝材做阴、阳极材料,经过电解处理形成的氧化铝膜,抗蚀能力强.其制备的简要流程如图.下列用来解释流程中反应的方程式不正确的是( )| A. | 碱洗目的是除去铝材表面的自然氧化膜:2OH-+Al2O3═2AlO2-+H2O | |
| B. | 碱洗时铝材表面会出现气泡:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| C. | 获得耐蚀铝材的电极反应为:4Al-12e-+3O2═2Al2O3 | |
| D. | 用稀氨水洗去耐蚀铝材表面的酸:NH3•H2O+H+═NH4++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醛可作食品防腐剂 | B. | 氢氧化铝可作抗酸药 | ||
| C. | 氯化钠可作食品调味剂 | D. | 生石灰可作食品干燥剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
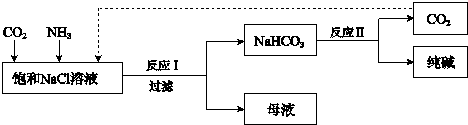
 2NH3.
2NH3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑤②③ | B. | ④②③ | C. | ⑤②④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
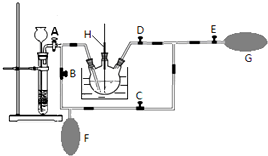
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com