
| A. | 探究SO2和Na2O2反应可能有Na2SO4生成 | |
| B. | 探究Na与水的反应可能有O2生成 | |
| C. | 探究浓盐酸与漂白粉在一定条件下能否反应生成Cl2 | |
| D. | 探究向滴有酚酞试液的NaOH溶液中通入Cl2,溶液红色褪去的现象是溶液的酸碱性改变,还是HClO的漂白性所致 |
分析 进行科学探究时,要有合理的理论依据,不能凭空猜测.二氧化硫还原性气体,可以与氧化剂反应生成三氧化硫,化学反应前后元素的种类不变,钠和水中含有钠元素、氢元素和氧元素,故生成物中含钠元素、氢元素和氧元素,钠是还原剂,所以水中元素化合价需降低,所以氧元素不可能再降低;铜为红色,浓硫酸与铜反应可能出现黑色物质CuO;依据氯气和碱反应,氯气与水反应生成次氯酸具有漂白性.
解答 解:A、二氧化硫具有还原性,过氧化钠具有氧化性,所以可以探究SO2和Na2O2反应可能有Na2SO4生成,故A不选;
B、根据质量守恒定律,化学反应前后元素的种类不变,钠和水中含有钠元素、氢元素和氧元素,猜测产生的气体可能为氧气,不符合氧化还原反应的基本规律,钠是还原剂,水只能做氧化剂,元素化合价需要降低,氧元素已是最低价-2价,不可能再降低,故B选;
C、浓硫酸与铜发生氧化还原反应,铜有可能被氧化为黑色的氧化铜,有探究意义,故C不选;
D、氯气和氢氧化钠反应生成氯化钠次氯酸钠和水,消耗氢氧化钠溶液红色褪去,氯气可以与水反应生成的次氯酸或生成的次氯酸钠水解生成次氯酸具有漂白性,有探究意义,故D不选;
故选B.
点评 本题考查了常见物质的化学反应中生成物的推测,完成此题,可以依据质量守恒定律、氧化还原反应规律、物质间的反应规律判断,题目难度中等.


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:填空题
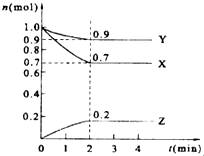 某温度时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL 0.1 mol•L-1 Na2SO4溶液中,粒子总数是0.03NA | |
| B. | 常温常压下,32 g O2-中所含电子的数目为17NA | |
| C. | 1 mol Al3+完全水解生成氢氧化铝胶体粒子的数目为NA | |
| D. | 标准状况下,分子数为NA的N2、C2H4混合气体的质量无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

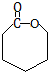
 $\stackrel{过氧化物}{→}$
$\stackrel{过氧化物}{→}$  (R,R′代表烃基)
(R,R′代表烃基) .
. .
. .
. .
. 或
或 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳氢键断裂的位置不相同 | |
| B. | 反应条件相同 | |
| C. | 反应产生的气体经净化处理后,均能使酸性高锰酸钾溶液褪色 | |
| D. | 产物相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl MgCl2NH4Cl | B. | H2O Na2O? CO2 | ||
| C. | CaCl2? NaOH H2O | D. | NH3•H2O CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸钙溶液中通入过量二氧化碳 Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| B. | 硫酸亚铁溶液中加过氧化氢溶液 Fe2++2H2O2+4H+═Fe3++4H2O | |
| C. | Fe2(SO4)3的酸性溶液中通入足量硫化氢 Fe3++H2S═Fe2++S↓+2H+ | |
| D. | 氯化亚铁溶液中加入稀硝酸 3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ | |
| B. | 氢氧化镁与硫酸溶液反应:OH-+H+═H2O | |
| C. | 氢氧化钡溶液与稀硫酸的反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 将金属Cu加入FeCl3溶液中:2Fe3++Cu═2Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学兴趣小组用如图装置进行氢气的制备:试回答下列问题:
某化学兴趣小组用如图装置进行氢气的制备:试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com