
【题目】如图是一定温度和压强下,反应aX+bY![]() cZ的速率—时间图象,下列叙述正确的是
cZ的速率—时间图象,下列叙述正确的是
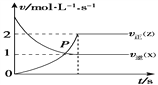
A. 该反应从正反应开始
B. a∶c=1∶2
C. 开始时,X的浓度为0,逆反应速率最小
D. 两条曲线相交的点P表示反应达到化学平衡
【答案】B
【解析】A.从图像可以看出,该反应在原点时正反应速率为0,无论以何种物质表示,正反应速率为均为0,即该反应从逆反应开始,故A错误;B. 从图像可以看出,该反应是在正逆反应速率不变时达到平衡,此时v逆(X):v正(Z)=1∶2,由于平衡时正逆反应速率相等,则v正(X):v正(Z)=1∶2,根据速率之比等与化学计量数之比,得a:c=1:2,故B正确;C. 开始时,X的浓度为0,正反应速率最小为0,逆反应速率最大,故C错误;D. 两条曲线相交的点P时,v逆(X)=v正(Z),不是用同一物质表示的正逆反应速率相等,不能表示反应达到化学平衡,故D错误;因此本题正确答案为B。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法中正确的是( )
A. 标准状况下,1molSO3的体积为22.4L
B. 1mol 二氧化氮与足量的水反应电子转移总数为3NA
C. 标准状况下,将22.4LSO2通入水中形成1L溶液,得到H2SO3的浓度为1mol/L
D. 常温下,23gNO2和N2O4的混合气体中含有NA个氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一瓶甲和乙的混合物,已知甲和乙的某些性质如表所示,据此将甲和乙互相分离的方法是( )
物质 | 熔点(℃) | 沸点(℃) | 密度(g·cm-3) | 水中溶解性 |
甲 | -98 | 57.5 | 0.93 | 可溶 |
乙 | -84 | 87 | 0.90 | 可溶 |
A. 蒸馏法 B. 结晶法 C. 萃取法 D. 过滤法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证还原性:SO2>Fe2+>C1-,三组同学分别进行了下图实验,并对溶液1和溶液2中所含离子进行了检验,能证明上述还原性顺序的实验组有
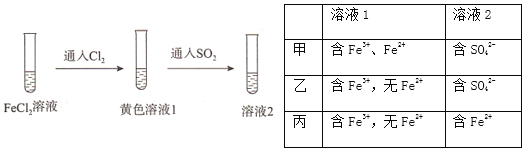
A. 只有甲 B. 甲、乙 C. 甲、丙 D. 甲、乙、丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将HC1气体通入到1L浓度均为0.1mol/L的NaA和NaB的混合溶液中,混合溶液的pH与离子浓度变化的关系如图所示(忽略溶液体积的变化)。下列叙述不正确的是
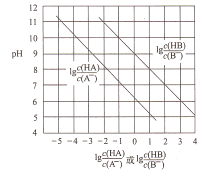
A. Ka(HB)的数量级为10-9
B. 酸性的强弱顺序为HCl>HA>HB
C. 当通入0.1molHC1气体时,c(B-)>c(A-)
D. 当混合溶液呈中性时,c(Na+)=c(Cl-)+c(A-)+c(B-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题:
Ⅰ.写出下列物质或微粒的电子式:
(1)CO2________
(2)N2___________
(3)Na2O__________
Ⅱ.下列物质:① CaBr2②H2O③NH4Cl④H2O2⑤Na2O2⑥Ca(OH)2⑦HClO⑧I2⑨He
(1)含有共价键的离子化合物是(用序号回答)________
(2)当其熔化时,不破坏化学键的是(用序号回答)_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(HCHO)俗称蚁醛,是一种重要的有机原料。
I.利用甲醇(CH3OH)制备甲醛
脱氢法:CH3OH(g)=HCHO(g)+H2(g) △H1 = +92.09kJ/mol
氧化法:CH3OH(g) +1/2O2(g)=HCHO(g)+H2O(g) △H2
(1)已知:2H2(g)+O2(g)=2H2O(g) △H3=-483.64 kJ/mol,则△H2=_______。
(2)与脱氢法相比,氧化法在热力学上趋势较大,其原因为_______________。
(3)图1为甲醇制备甲醛反应的lg K(K为平衡常数)随温度(T)的变化曲线。曲线____(填“a”或“b”)对应脱氢法,判断依据为_________________。

II.甲醛的用途
(4)将甲醛水溶液与氨水混合蒸发可制得乌洛托品(结构简式如图2),该物质在医药等工业中有广泛用途。若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为_______。
(5)将甲醛水溶液与硫酸镍(NiSO4)混合,可用于化学镀镍。若反应过程中有CO2产生,则该反应的离子方程式为____________________。
Ⅲ.甲醛的检测
(6)室内甲醛超标会危害人体健康,通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的原理如图3所示,则b极的电极反应式为_________,当电路中转移4×10-4 mol电子时,传感器内参加反应的HCHO为_______mg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C的简单离子和B的简单离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物中阴阳离子的个数比为1:1。回答下列问题:
(1)五种元素中,原子半径最大的是____________(填元素名称),非金属性最强元素的是___________。
(2)由元素A分别和元素B、D、E所形成的共价型化合物中,热稳定性最差的是
______________(用化学式表示)。
(3)元素A和E形成的化合物与元素A和B形成的化合物反应,产物的电子式为_________________,其中存在的化学键类型为_________________________。
(4)E离子的结构示意图是____________________;
元素D最高价氧化物的水化物的化学式为_________________。
(5)单质E与水反应的离子方程式为 ____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com