
配制100mL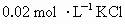 溶液时,某学生将准确称量的1.49gKCl固体放入烧杯中,加入约30mL蒸馏水,用玻璃棒搅拌使其溶解.将溶液由烧杯倒入100mL容量瓶中,然后往容量瓶中小心地加入蒸馏水.直到液面接近刻度线2cm~3cm处.改用胶头滴管加蒸馏水,使溶液凹液面最低点恰好与刻度线相切.把容量瓶塞紧,再振荡摇匀.该生操作中的错误是______和________.
溶液时,某学生将准确称量的1.49gKCl固体放入烧杯中,加入约30mL蒸馏水,用玻璃棒搅拌使其溶解.将溶液由烧杯倒入100mL容量瓶中,然后往容量瓶中小心地加入蒸馏水.直到液面接近刻度线2cm~3cm处.改用胶头滴管加蒸馏水,使溶液凹液面最低点恰好与刻度线相切.把容量瓶塞紧,再振荡摇匀.该生操作中的错误是______和________.
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:022
配制100mL 溶液时,某学生将准确称量的1.49gKCl固体放入烧杯中,加入约30mL蒸馏水,用玻璃棒搅拌使其溶解.将溶液由烧杯倒入100mL容量瓶中,然后往容量瓶中小心地加入蒸馏水.直到液面接近刻度线2cm~3cm处.改用胶头滴管加蒸馏水,使溶液凹液面最低点恰好与刻度线相切.把容量瓶塞紧,再振荡摇匀.该生操作中的错误是______和________.
溶液时,某学生将准确称量的1.49gKCl固体放入烧杯中,加入约30mL蒸馏水,用玻璃棒搅拌使其溶解.将溶液由烧杯倒入100mL容量瓶中,然后往容量瓶中小心地加入蒸馏水.直到液面接近刻度线2cm~3cm处.改用胶头滴管加蒸馏水,使溶液凹液面最低点恰好与刻度线相切.把容量瓶塞紧,再振荡摇匀.该生操作中的错误是______和________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com