
分析 A、B、C、D、E为原子序数依次增大的五种元素,A原子核外L层电子数是K层的两倍,则A为C;B是地壳中含量最高的元素,则B为O;C是元素周期表中电负性最大的元素,则C为F;D原子核外的M层中只有两对成对电子,则D为S;E有七个能级,内层电子总数是最外层电子数的9倍,则E为Ca,据此答题;
解答 解:A、B、C、D、E为原子序数依次增大的五种元素,A原子核外L层电子数是K层的两倍,则A为C;B是地壳中含量最高的元素,则B为O;C是元素周期表中电负性最大的元素,则C为F;D原子核外的M层中只有两对成对电子,则D为S;E有七个能级,内层电子总数是最外层电子数的9倍,则E为Ca,
(1)B为O,C为F,D为S,位于同一周期,自左而右电负性逐渐增大,位于同一主族从上向下电负性逐渐减小,所以B、C、D三种元素电负性由大到小的顺序是F>O>S,S原子的核外电子排布式为1s22s22p63s23p4,
故答案为:F>O>S,1s22s22p63s23p4;
(2)化合物DB2为SO2,SO2中硫原子的价层电子对数为$\frac{6}{2}$=3,分子中有两个σ键,所以分子立体构型为V型,
故答案为:V型;3;
(3)化合物AB2为CO2,CO2中心原子为碳原子,其价层电子对数为$\frac{4}{2}$=2,所以碳原子的杂化轨道类型为sp,水为极性分子,SO2为极性分子,CO2为非极性分子,根据相似相溶原理可知,相同条件下,CO2和SO2在水中溶解度较大的是SO2,
故答案为:sp;SO2;SO2为极性分子,CO2为非极性分子;
(4)节日燃放的焰火、激光的产生都与不同能级上的电子发生跃迁有关,E与C形成的化合物为CaF2,所属的晶体类型为离子晶体,
故答案为:不同能级上的电子发生跃迁;离子晶体;
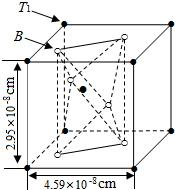
(5)B为O,利用均摊法可知,晶胞中含有氧原子数为4×$\frac{1}{2}$+2=4,钛原子数为8×$\frac{1}{8}$+1=2,所以化合物F的化学式为TiO2,TiO2的晶胞上、下面为正方形,所以晶胞的体积为(4.58×10-8)×2.95×10-8 cm3 =6.188×10-23cm3 ,每个晶胞的质量为$\frac{2M}{{N}_{A}}$g,所以每千克TiO2含有的晶胞数是$\frac{1000}{\frac{2M}{{N}_{A}}}$=$\frac{500{N}_{A}}{M}$,
故答案为:TiO2;$\frac{500{N}_{A}}{M}$;6.188×10-23cm3 .
点评 本题是对物质结构与性质的考查,推断元素是解题关键,涉及电负性的比较、核外电子排布、分子结构与性质、晶体类型、晶胞的密度计算等,综合性较强,难度中等,对学生综合运用知识的能力要求较高.


科目:高中化学 来源: 题型:选择题
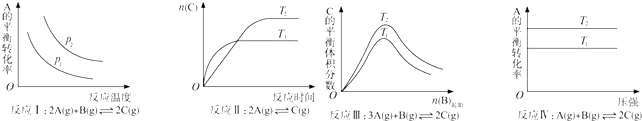
| A. | 反应Ⅰ:△H>0,P2>P1 | B. | 反应Ⅱ:△H<0,T1>T2 | ||
| C. | 反应Ⅲ:△H>0,T2<T1;或△H<0,T2>T1 | D. | 反应Ⅳ:△H<0,T2>T1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
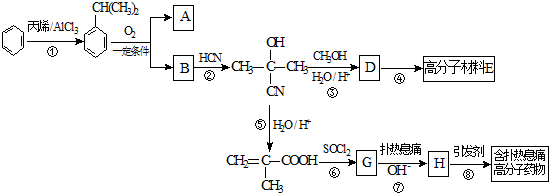
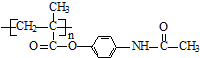 .
.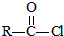
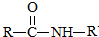 $\stackrel{NaOH溶液}{→}$RCOONa+R′-NH2
$\stackrel{NaOH溶液}{→}$RCOONa+R′-NH2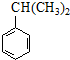 可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式
可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式 .
.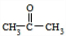 ;扑热息痛的结构简式为
;扑热息痛的结构简式为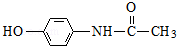 .
.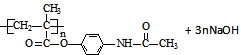 →
→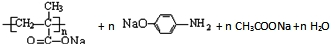 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO3 | B. | H2SeO3 | C. | H3PO4 | D. | HMnO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH固体 | B. | 同浓度的醋酸溶液 | ||
| C. | NH4Cl固体 | D. | CH3COONa固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 碳酸钙溶于稀盐酸中:CO32-+2H+═H2O+CO2↑ | |
| C. | 钠与水反应:2Na+2H2O═2Na++2OH -+H2↑ | |
| D. | 硫酸铝溶液与氨水反应:Al3++3 OH -═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用焦炭在电炉中还原二氧化硅制取硅单质 | |
| B. | 用煤炭作燃料发电 | |
| C. | 用铁矿石炼铁 | |
| D. | 用纯碱制玻璃 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com