
| 50g | 20g | 20g | 10g | 5g |

分析 (1)根据先加质量大的砝码,再换小砝码,最后使用游码的原则完成;
(2)根据500mL 0.1mol/L Na2CO3溶液含有的碳酸钠的物质的量计算出碳酸钠的质量;根据配制一定物质的量浓度的溶液的步骤进行排序;
(3)根据实验操作对c=$\frac{n}{V}$产生的影响进行分析.
解答 解:(1)某药品质量约为32g,用托盘天平准确称其质量,先在右盘加入50g砝码,质量过大,表示为:50g↓↑;然后换20g砝码,砝码质量不足,表示为:20g↓;再加20g砝码,20g砝码质量过大,表示为:↓↑;换10g砝码,10g砝码质量不足,表示为:10g↓;再加5g砝码,5g砝码质量过大,拿下5g砝码,表示为:5g↓↑;最后移动游码到2g进行调平,
故答案为:
| 50g | 20g | 20g | 10g | 5g |
| ↓↑ | ↓ | ↓↑ | ↓ | ↓↑ |
点评 本题考查了配制一定物质的量浓度的溶液步骤及误差分析,题目难度不大,注意熟练掌握配制一定物质的量浓度的溶液的方法,多积累误差分析的方法和技巧.


科目:高中化学 来源: 题型:解答题
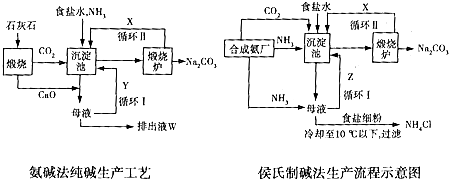
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于C(s)+H2O(g)?CO(g)+H2(g)反应,在一定条件下达到平衡,增加或减少C(s)的量平衡不移动 | |
| B. | 对于2SO2(g)+O2(g)?2SO3(g)反应,当密度保持不变,在恒温恒容或恒温恒压条件下,均不能作为达到化学平衡状态的标志 | |
| C. | 对于C(s)+CO2(g)?2CO(g)反应,当密度保持不变,在恒温恒容或恒温恒压条件下,均能作为达到化学平衡状态的标志 | |
| D. | 对于I2(g)+H2(g)?2HI(g)反应,加入催化剂或增大压强均能缩短达到平衡所用时间,但HI的百分含量保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 平衡向逆反应方向移动 | B. | a+b<c+d | ||
| C. | Z的体积分数增加 | D. | X的转化率提高 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 已知:2NO2(g)?N2O4(g)△H=-52.7kJ/mol,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
已知:2NO2(g)?N2O4(g)△H=-52.7kJ/mol,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向碳酸钠溶液中加醋酸 CO32-+2H+═H2O+CO2↑ | |
| B. | 向稀硫酸溶液中投入铁粉 2Fe+6H+═2Fe3++3H2↑ | |
| C. | 向盐酸中投入碳酸钙 CO32-+2H+═H2O+CO2↑ | |
| D. | 硫酸氢钠溶液中加入氢氧化钡溶液至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②③ | C. | ②④ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若温度不变将容器的容积增大1倍,达到新平衡时A的浓度变为原来的0.55 倍,则m+n<p+q | |
| B. | 若升高平衡体系的温度,达到新平衡时A 的浓度变为原来的0.55 倍,说明该反应△H<0 | |
| C. | 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n | |
| D. | 若平衡后同时增大A、B的浓度,则A、B的转化率一定都减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com