
分析 (1)①结合c(OH-)=$\sqrt{\frac{Ksp}{c(C{u}^{2+})}}$、c(H+)=$\frac{Kw}{c(O{H}^{-})}$、pH=-lgc(H+)计算;
②使溶液中Cu2+的浓度为2×10-6mol?L-1,c(OH-)=$\sqrt{\frac{Ksp}{c(C{u}^{2+})}}$计算;
(2)①等体积等浓度混合,c(Na+)>c(A-),可知HA为弱酸,溶液中NaA水解显碱性;
②如果取0.2mol/L HA溶液与 0.1mol/L NaOH 溶液等体积混合,则溶液中的溶质是NaA和HA,且二者的物质的量浓度相等,测得混合溶液的pH<7,说明酸的电离程度大于酸根离子的水解程度.
解答 解:(1)①c(OH-)=$\sqrt{\frac{Ksp}{c(C{u}^{2+})}}$=$\sqrt{\frac{2×1{0}^{-20}}{0.02}}$=1×10-9,c(H+)=$\frac{Kw}{c(O{H}^{-})}$=$\frac{1{0}^{-14}}{1{0}^{-9}}$=10-5,pH=-lgc(H+)=5,应调整溶液的pH最小为5,故答案为:5;
②使溶液中Cu2+的浓度为2×10-6mol?L-1,c(OH-)=$\sqrt{\frac{Ksp}{c(C{u}^{2+})}}$=$\sqrt{\frac{2×1{0}^{-20}}{2×1{0}^{-6}}}$=1×10-7,c(H+)=$\frac{Kw}{c(O{H}^{-})}$=10-7,pH=-lgc(H+)=7,应向溶液里加入NaOH溶液,使溶液的pH为7,故答案为:7;
(2)①酸或碱抑制水电离,含有弱根离子的盐促进水电离,所以混合溶液中,由水电离出来的c(OH-)>0.2mol/L HA溶液中由水电离出的c(H+),
故答案为:>;
②如果取0.2mol/L HA溶液与 0.1mol/L NaOH 溶液等体积混合,则溶液中的溶质是NaA和HA,且二者的物质的量浓度相等,测得混合溶液的pH<7,说明酸的电离程度大于酸根离子的水解程度,
故答案为:>.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握Ksp的计算、酸碱混合为解答的关键,侧重分析与计算能力的考查,注意Ksp与离子浓度的关系,题目难度不大.


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | AlCl3与NH3•H2O | B. | NaOH、MgSO4 | C. | Al2(SO4)3、NaOH | D. | BaCl2、H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg(OH)2的溶解度最小 | B. | Ca(OH)2的溶解度最小 | ||
| C. | AgCl的溶解度最小 | D. | 相同条件下Ksp越小的溶解度越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
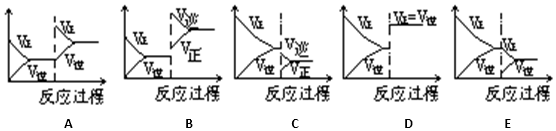
| 达到新的平衡对应的图象 (填写字母) | 平衡移动方向 (正反应、逆反应,不移动) | |
| (1)使用催化剂 | ||
| (2)升温 | ||
| (3)降压 | ||
| (4)增加A的量 | ||
| (5)减少C的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)3胶体区别于其他分散系的本质特征是分散质粒子的直径在10-9~10-7米之间 | |
| B. | 分别用一束光透过三种分散系,只有Fe(OH)3胶体具有丁达尔效应 | |
| C. | 往FeCl3溶液中加入NaOH溶液,并适当加热,可制得Fe(OH)3胶体 | |
| D. | 三种分散系中分散质均属于电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
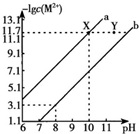 25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgC(M2+)]与溶液PH的变化关系如图所示,已知:该温度下,Ksp[Cu(OH)2]<Ksp[Fe(OH)2].下列说法正确的是( )
25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgC(M2+)]与溶液PH的变化关系如图所示,已知:该温度下,Ksp[Cu(OH)2]<Ksp[Fe(OH)2].下列说法正确的是( )| A. | b线表示Fe(OH)2饱和溶液中的变化关系,且Ksp[Fe(OH)2]=10-15.1 | |
| B. | 当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中C(Fe2+):C(Cu2+)=1:104.6 | |
| C. | 向X点对应的饱和溶液中加入少量NaOH,可转化为Y点对应的溶液 | |
| D. | 除去CuSO4溶液中含有的少量Fe2+,可加入适量CuO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.045 mol/L | B. | 1 mol/L | C. | 0.5 mol/L | D. | 2.24mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com