
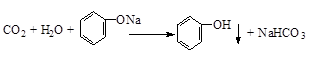 .
.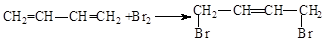 .
.分析 (1)溴乙烷和NaOH的乙醇溶液加热发生消去反应生成乙烯;
(2)二氧化碳通入苯酚钠中生成苯酚、碳酸氢钠;
(3)1,3-丁二烯和溴发生1,4加成生成1,4-二溴-2-丁烯;
(4)葡萄糖与银氨溶液发生银镜反应生成葡萄糖酸铵、银、氨气和水.
解答 解:(1)溴乙烷和NaOH的醇溶液加热发生消去反应生成乙烯,反应方程式为CH3CH2Br+NaOH$→_{△}^{乙醇}$CH2=CH2↑+NaBr+H2O,
故答案为:CH3CH2Br+NaOH$→_{△}^{乙醇}$CH2=CH2↑+NaBr+H2O;
(2)二氧化碳通入苯酚钠中生成苯酚、碳酸氢钠,反应方程式为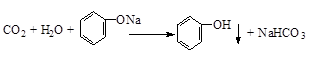 ,
,
故答案为: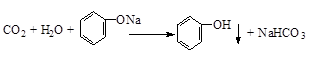 ;
;
(3)1,3-丁二烯和溴发生1,4加成生成1,4-二溴-2-丁烯,反应方程式为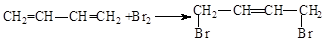 ,
,
故答案为: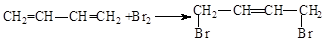 ;
;
(4)葡萄糖与银氨溶液发生银镜反应生成葡萄糖酸铵、银、氨气和水,反应方程式为CH2OH(CHOH)4CHO+2Ag(NH3)2OH $\stackrel{水浴加热}{→}$CH2OH(CHOH)4COONH4+2Ag↓+3NH3+H2O,
故答案为:CH2OH(CHOH)4CHO+2Ag(NH3)2OH $\stackrel{水浴加热}{→}$CH2OH(CHOH)4COONH4+2Ag↓+3NH3+H2O.
点评 本题考查化学反应方程式的书写,为高频考点,会根据反应物、生成物及反应条件书写方程式,明确官能团及其性质关系,知道断键和成键位置,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 科学家致力于二氧化碳的“组合转化”技术的研究,把过多二氧化碳转化为有益于人类的物质.
科学家致力于二氧化碳的“组合转化”技术的研究,把过多二氧化碳转化为有益于人类的物质. 代表氢原子,
代表氢原子, 代表碳原子)和水,该有机物的结构简式为CH2=CH2.
代表碳原子)和水,该有机物的结构简式为CH2=CH2.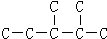 ,该烷烃的名称为2,3-二甲基戊烷;其一溴代物有6种.
,该烷烃的名称为2,3-二甲基戊烷;其一溴代物有6种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用高锰酸钾溶液杀死水果周围的细菌,防止水果霉变 | |
| B. | 利用高锰酸钾溶液吸收水果周围的氧气,防止水果腐烂 | |
| C. | 利用高锰酸钾溶液吸收水果产生的乙烯,防止水果早熟 | |
| D. | 利用高锰酸钾溶液的氧化性,催熟水果 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、NO${\;}_{3}^{-}$、K+、SO${\;}_{4}^{2-}$ | B. | Cu2+、Ba2+、SO${\;}_{4}^{2-}$、CO${\;}_{3}^{2-}$ | ||
| C. | OH-、Cl-、NH${\;}_{4}^{+}$、Na+ | D. | Mg2+、Na+、SO${\;}_{4}^{2-}$、NO${\;}_{3}^{-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘-127和碘-131的核外电子数之比为127:131 | |
| B. | 碘-127和碘-131的核内中子数之比为127:131 | |
| C. | 碘-127和碘-131的核内中子数与质子数之差的比值为1:1 | |
| D. | 碘-127和碘-131的核内质子数与核外电子数之和的比值为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 )易溶于水,常用做汽水,糖果的添加剂.下列有关说法中,正确的是( )
)易溶于水,常用做汽水,糖果的添加剂.下列有关说法中,正确的是( )| A. | 苹果酸属于烃 | B. | 苹果酸中有3种官能团 | ||
| C. | 苹果酸的分子式是C3H6O5 | D. | 苹果酸能使紫色石蕊溶液变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将SO2通入含HClO的溶液中生成H2SO4,酸性:HClO>H2SO4 | |
| B. | 铝箔在酒精灯火焰上加热熔化但不滴落,说明铝箔表面氧化铝熔点高于铝 | |
| C. | SiO2可以和NaOH溶液及HF溶液反应,SiO2属于两性氧化物 | |
| D. | SO2使溴水褪色,SO2具有漂白性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com