
运用化学反应原理研究部分单质及其化合物的反应有重要意义。
 (1)氨是氮循环过程中的重要物质,是氮肥工业的重要原料。氨的合成目前普遍使用的人工固氮方法:N2(g)+3H2(g)
(1)氨是氮循环过程中的重要物质,是氮肥工业的重要原料。氨的合成目前普遍使用的人工固氮方法:N2(g)+3H2(g) 2NH3(g)。请回答:
2NH3(g)。请回答:
①已知:H-H键能为436kJ/mol,N N键能为945kJ/mol,N一H键能为391kJ/mol.由键能计算消耗1molN2时的△H=_________。若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡_______移动(填“向左”、“向右”或“不”);
②如图中:当温度由T1变化到T2时,KA______KB(填“>”、“<”或“=”)。
(2)氨气溶于水得到氨水。NO2可用氨水吸收生成NH4NO3,25℃时,将amolNH4NO3溶于水,溶液显酸性,原因是___________(用离子方程式表示),向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将__________(填“正向”、“不”或“逆向”)移动,所滴加氨水的浓度为________mol/L(用含a、b的代数式表示),(NH3·H2O的电离平衡常数取Kb=2×10-5mol/L)
(3)硫酸生产中,SO2催化氧化生成SO3:SO2(g)+1/2O2(g) SO3(g)△H<0,是工业上生产硫酸的关键步骤。
SO3(g)△H<0,是工业上生产硫酸的关键步骤。
①在某温度时,该反应的平衡常数K=0.75,若在此温度下,向100L的恒容密闭容器中,充入3mol SO2、4mol O2和4mol SO3,则反应开始时正反应速率________逆反应速率(填“<”、“>”或“=”)。
②在①中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是________。
a.保持温度和容器体积不变,充入1.0mol SO3(g)
b.保持温度和容器内压强不变,充入2.0mol He
c.降低温度
d.在其他条件不变时,减小容器的容积
③由硫酸可制得硫酸盐.在一定温度下,向K2SO4溶液中滴加Na2CO3溶液和BaCl2溶液,当两种 沉淀共存时,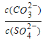 =_________。
=_________。
[已知该温度时,Ksp(BaSO4)=1.3×10-10,Ksp(BaCO3)=5.2×10-9]
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015-2016学年甘肃省高二上期中(文)化学试卷(解析版) 题型:选择题
医生建议患甲状腺肿大的病人多吃海带,这是由于海带中含较丰富的
A.碘元素 B.铁元素 C.钾元素 D.锌元素
查看答案和解析>>
科目:高中化学 来源:2015-2016学年海南省高二上期中(文)化学试卷(解析版) 题型:选择题
室内空气污染的主要来源之一是现代人生活中使用的化工产品,加泡沫绝缘材料的办公家具、化纤地毯、壁纸及书报、油漆等不同程度放出气体,该气体是
A.甲醛 B.乙烯 C.一氧化碳 D.甲烷
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期期中测试化学试卷(解析版) 题型:填空题
以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料,制取氧化钴的流程如下:
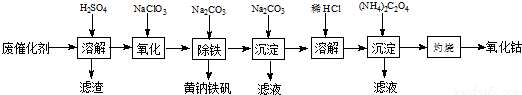
(1)溶【解析】
溶解后过滤,将滤渣洗涤2~3次,洗液与滤液合并,其目的是_________________,所得滤渣的主要成分是_________(写化学式)。
(2)氧化:加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,其离子方程式_________________。
已知:铁氰化钾化学式为K3[Fe(CN)6];亚铁氰化钾化学式为K4[Fe(CN)6]•3H2O.
3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4-=Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是______________。(可供选择的试剂:铁氰化钾溶液、亚铁氰化钾溶液、铁粉、KSCN溶液)
(3)除铁:加入适量的Na2CO3调节酸度,生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的化学方程式______________。
(4)沉淀:生成沉淀碱式碳酸钴[(CoCO3)2•3Co(OH)2],沉淀需洗涤,洗涤的操作是______________。
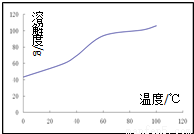
(5)溶【解析】
CoCl2的溶解度曲线如图所示向碱式碳酸钴中加入足量稀盐酸,边加热边搅拌至完全溶解后,需趁热过滤,其原因是______________。
(6)灼烧:准确称取所得CoC2O4 1.470g,在空气中充分灼烧得0.830g氧化钴,写出氧化钴的化学式_________。
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三上学期期中测试化学试卷(解析版) 题型:选择题
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示,常温下,S2Cl2是种橙黄色液体,遇水易水解,并产生能使品红褪色的气体,化学方程式为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl下列说法中错误的是
A.S2Cl2的结构式为Cl-S-S-Cl
B.反应中SO2是还原产物,S是氧化产物
C.S2Cl2为含有极性键和非极性键的分子
D.反应中,生成1molSO2,转移电子为3mol
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高二上期中测试化学试卷(解析版) 题型:选择题
在容积固定的密闭容器中,进行下列反应A(g)+B(g) 2C(?)+D(g),此反应符合下列两个图像(其中φ代表物质的百分含量),则下列判断正确的是( )
2C(?)+D(g),此反应符合下列两个图像(其中φ代表物质的百分含量),则下列判断正确的是( )

A.物质C不可能为气态
B.正反应为吸热反应
C.该反应,升高温度平衡正向移动
D.300℃下该反应到达平衡状态后,迅速充入He,平衡正向移动
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二上11月月考化学试卷(解析版) 题型:填空题
在如图所示的装置中,若通直流电5min时,铜电极质量增加2.16 g。试回答下列问题。
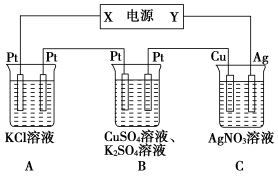
(1)电源中X电极为直流电源的________极。
(2)pH变化:A:________,B:________,C:________。(填“增大”、“减小”或“不变”)
(3)通电5 min时,B中共收集224 mL (标准状况下) 气体,溶液体积为200 mL,则通电前CuSO4溶液的物质的量浓度为________(假设电解前后溶液体积无变化)。
(4)若A中KCl足量且溶液的体积也是200 mL,电解后,溶液的pH为________(假设电解前后溶液体积无变化)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高一上期中测试化学试卷(解析版) 题型:选择题
下列物质在水中的电离方程式书写正确的是
A.NaHSO4===Na++HSO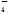 B.NaHCO3===Na++H++CO32-
B.NaHCO3===Na++H++CO32-
C.KClO3===K++Cl-+3O2- D.Al2(SO4)3===2Al3++3SO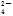
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高二上第二次质检化学试卷(解析版) 题型:选择题
下列说法正确的是
A.某气体通入品红溶液中,能使其褪色,则该气体为二氧化硫
B.向Fe(NO3)2溶液中滴加稀盐酸溶液变成黄色
C.某无色溶液中加入盐酸酸化的BaCl2溶液有白色沉淀生成,则原溶液中含有SO42-
D.钠在空气中燃料产物为白色固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com