
����Ŀ����ҵ���������������ϴ�������Ҫ�ɷ�ΪAl2O3������������Pd(��)����������������Pd���������£�

�ش��������⣺
��1������������Һ����Ũ������ȴ�õ�ʮ��ˮ�����������壬�ù���Ļ�ѧʽΪ___��
��2������ʱAl2O3��(NH4)2SO4��Ӧ�Ļ�ѧ����ʽΪ___��
��3����ˮ��Ũ�����Ũ���ᰴ�����Ϊ___�Ļ�����ˮ���ȶ�������ʱ��������������(NOCl)���������÷�Ӧ�Ļ�ѧ����ʽΪ___��
��4����ҺY�к�PdԪ�ص�������H2PdCl6(������)���������ʱ��Ӧ�Ļ�ѧ����ʽΪ___��
��5�������Ȼ�ԭ���еõ��Ĺ���ֻ��Pd��ÿ����1molPdʱ���ɵ���������ʵ���Ϊ___��
��6��Pd�������Ĵ���������䴢��ԭ��Ϊ2Pd��s��+xH2��g���T2PdHx��s��������x�����ֵΪ0.8����֪��Pd���ܶ�Ϊ12gcm��3����21.2cm3Pd�ܴ����״����H2��������Ϊ___L��
���𰸡�Al2(SO4)3��18H2O 3(NH4)2SO4+Al2O3![]() Al2(SO4)3+6NH3��+3H2O�� 1��3 HNO3(Ũ) +3HCl(Ũ)
Al2(SO4)3+6NH3��+3H2O�� 1��3 HNO3(Ũ) +3HCl(Ũ)![]() NOCl��+Cl2��+2H2O Pd+6HCl+4HNO3=H2PdCl6+4NO2��+4H2O 8mol 21.504
NOCl��+Cl2��+2H2O Pd+6HCl+4HNO3=H2PdCl6+4NO2��+4H2O 8mol 21.504
��������
�ϴ���������立�Ӧ���ɰ�����������������Pd����ˮ��Ӧ����������ԭ��Ӧ����д����ʽ���Լ���ˮ���Ӧ��������֪��Ϣд��(NH4)2PdCl6 ��H2��Ӧ�ó�������������ʵ����������ù�ϵʽ����Pd���������������
�Ž���������Һ����Ũ������ȴ�õ�ʮ��ˮ�����������壬�ᾧˮд�����Ҫ��СԲ��������ù���Ļ�ѧʽΪAl2(SO4)3��18H2O��
�ʴ�Ϊ��Al2(SO4)3��18H2O��
�Ƹ��� ǰ����ϵ���ó�����ʱAl2O3��(NH4)2SO4��Ӧ�Ļ�ѧ����ʽΪ3(NH4)2SO4+Al2O3
ǰ����ϵ���ó�����ʱAl2O3��(NH4)2SO4��Ӧ�Ļ�ѧ����ʽΪ3(NH4)2SO4+Al2O3![]() Al2(SO4)3+6NH3��+3H2O����
Al2(SO4)3+6NH3��+3H2O����
�ʴ�Ϊ��3(NH4)2SO4+Al2O3![]() Al2(SO4)3+6NH3��+3H2O����
Al2(SO4)3+6NH3��+3H2O����
����ˮ��Ũ�����Ũ���ᰴ�����Ϊ1:3�Ļ�����ˮ���ȶ�������ʱ��������������(NOCl)��������HNO3(Ũ)���ϼ۽��ͱ�ΪNOCl�������ữ�ϼ����߱�Ϊ��������˸÷�Ӧ�Ļ�ѧ����ʽΪHNO3(Ũ) +3HCl(Ũ)![]() NOCl��+Cl2��+2H2O��
NOCl��+Cl2��+2H2O��
�ʴ�Ϊ��HNO3(Ũ) +3HCl(Ũ)![]() NOCl��+Cl2��+2H2O��
NOCl��+Cl2��+2H2O��
�Ƚ�ҺY�к�PdԪ�ص�������H2PdCl6(������)���ٸ���ͼ����Ϣ��������H2PdCl6(������)��ͬʱ�������˶�������������������ʱ��Ӧ�Ļ�ѧ����ʽΪPd+6HCl+4HNO3 = H2PdCl6+4NO2��+4H2O��
�ʴ�Ϊ��Pd+6HCl+4HNO3=H2PdCl6+4NO2��+4H2O��
�������Ȼ�ԭ���еõ��Ĺ���ֻ��Pd������(NH4)2PdCl6 + 2H2 = Pd + 6HCl��+ 2NH3����Ӧ��ÿ����1mol Pdʱ���ɵ���������ʵ���Ϊ8 mol��
�ʴ�Ϊ��8 mol��
��Pd�������Ĵ���������䴢��ԭ��Ϊ2Pd��s��+xH2��g���T2PdHx��s��������x�����ֵΪ0.8����֪��Pd���ܶ�Ϊ12gcm��3����21.2cm3Pd����m = 21.2cm3��12gcm��3=254.4g�������ʵ���![]() ��
��

���x = 2.4mol0.8mol��2mol=0.96 mol
�ܴ����״����H2��������Ϊ![]() ��
��
�ʴ�Ϊ21.504 L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й���ͳ�Ļ��а�������Ƽ�֪ʶ�����й��������漰��ѧ�仯����
ǧ�����������࣬������ɳʼ���� |
������(CuSO4��5H2O) ��������֮�Ϊͭ |
��ʯ��(CaCO3)�� �������Ϊ�� |
��ɰ(HgS)��֮��ˮ���������ֳɵ�ɰ |
A | B | C | D |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ��һ����Ҫ�ķ�Ӧ��
��1��ijͬѧд������������ѧ����ʽ(δ��ƽ)
��N2O4��H2O��HNO3��HNO2 ��NO��HNO3��N2O3��H2O ��NH3��NO��HNO2��H2O
��������Ϊһ��������ʵ�ֵ��ǣ�����ţ�____________��
��2�����·�Ӧ��H2O2�����ֻ�ԭ�Ե��ǣ�����ţ�____________��H2O2�����������������ֻ�ԭ�Ե��ǣ�����ţ�____________���ӷ�Ӧ���ж�H2O2��Ag2O��K2CrO4��������ǿ������˳����_______________��
A��H2O2+2Fe2++2H+=2Fe3++2H2O
B��2H2O2=2H2O+O2��
C��Ag2O+H2O2=2Ag+O2��+H2O
D��3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
E��H2O2+MnSO4=MnO2+H2SO4
��3������˫���ŷ����������·�Ӧ�е���ת�Ƶķ������Ŀ________������Ӧ����3.01��1023������ת�ƣ��������Ļ�ԭ�������ʵ���Ϊ___________��
2KMnO4��16HCl��Ũ��=2KCl��2MnCl2��5Cl2����8H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�Ƚ�![]() ��
��![]() ��
��![]() �ֽⷴӦ�Ĵ�Ч�����ס�����λͬѧ�ֱ��������ͼ�мס�����ʾ��ʵ�顣���������в���ȷ����
�ֽⷴӦ�Ĵ�Ч�����ס�����λͬѧ�ֱ��������ͼ�мס�����ʾ��ʵ�顣���������в���ȷ����![]() ����
����![]()
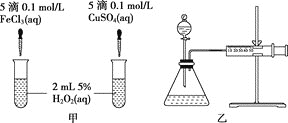
A. ͼ����ʾʵ���ͨ���۲�������ݵĿ������ȽϷ�Ӧ���ʵĴ�С
B. ��ͼ����ʾʵ���з�Ӧ����Ϊ�٣�������˵��![]() һ����
һ����![]() ��
��![]() �ֽ�Ĵ�Ч����
�ֽ�Ĵ�Ч����
C. ��ͼ����ʾװ�òⶨ��Ӧ���ʣ��ɲⶨ��Ӧ�����������������Ӧʱ��
D. Ϊ���ͼ����ʾװ�õ������ԣ��ɹرշ�Һ©���Ļ�������ע������������һ�����룬һ��ʱ����ɿ��������۲�����Ƿ�ص�ԭλ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ȼ��ⱥ��ʳ��ˮ��ȡNaOH�Ĺ�������ʾ��ͼ���£�

������ͼ�����������գ�
��1���Ӻ�ˮ�л�ȡ���εķ�����___��
��2���������������У�����ȥ����ˮ�е�Ca2+��Mg2+��SO42-���ɽ��еIJ����У�
A. ����
B. �ӹ���BaCl2��Һ
C. ������ϡ����
D. �ӹ���NaOH��Һ
E. �ӹ���Na2CO3��Һ
����ȷ������˳����___(����ĸ)��
�ڲ���B��Ŀ����___
�۲���C��Ŀ����___
�ܲ���D�з�����Ӧ�����ӷ���ʽ��___
�ݴ˲����е�ϡ�����ܷ���ϡ�������?____(����������������)��������___��
��3������������������Һ����Ȼ����NaCl�ķ�����___���۲쵽��������___��
��4���������������У�ͨ������Ũ������ȴ�ᾧ��___�ķ�����ȥNaCl���÷�����ԭ������ͬ�¶���NaCl��NaOH���ܽ�Ȳ�ͬ���ڸò����¶��£��ܽ�Ƚϴ����___��
��5�����������п�ѭ��ʹ�õ�������______��(�ѧʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�ǹ�ҵ������þ��(��Ҫ��MgCO3��������Al2O3��FeCO3����)��ȡ�Ȼ�þ�Ĺ������̡�

����˵������ȷ����
A.���������X��������
B.��������ͨ��������Ŀ���ǽ�Fe2+����ΪFe3+
C.���ɵij�����ΪFe(OH)3��Al(OH)3
D.�ڹ�ҵ�ϳ����õ�������Ȼ�þ�ķ�����ȡ����þ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ж����ʵ�������������ʵ����
A.����ˮ�����ڸ����µķ�Ӧ����ΪFe3O4��H2
B.��һС�ձ��зֱ����������ˮ��ú�ͣ�Ƭ�̺�������ձ��л����ؼ���һ�̶�����Ľ����ƣ����ܹ۲쵽����������ͼ

C.�ýྻ�IJ�˿պȡ����Һ�����ھƾ��ƻ��������գ��۲쵽����ʻ�ɫ�����������Һ��һ������Na+������K+
D.������ǯ��ס�����ھƾ����ϼ������ۻ�������ζ�����Һ̬������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A����̬������ȫȼ��ʱ������CO2�ͣ�H2O�����ʵ���֮��Ϊ1��1��A����Է�����С��30������ͼ��ʾ�ı仯�У��м����C��������һ��Ҳ�������Ƶ�Cu(OH)2������Ӧ����ש��ɫ������E����ζ��F�Ǹ߷��ӻ�����(��Ӧ����δд��)��
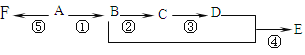
д�����и����仯�Ļ�ѧ����ʽ����Ӧ���͡�
��Ӧ��______��_______________
��Ӧ��______��________________
��Ӧ��______��___________________
��Ӧ��______��________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A.�ڴ�ͭ�ľ��������У�����·��ת��1 mol ���ӣ�����������һ��������32 g
B.��Ӧ8NH3(g)+6NO2(g)=7N2(g)+12H2O(g) ��H<0����÷�Ӧһ�����Է�����
C.1.2g�Ľ��ʯ��12g ��SiO2�ֱ���0.4mol��C-C����0.4mol ��Si-O ��
D.�����£���NH4Cl��Һ�м�������NaOH���壨��Һ�¶�û�б仯������Һ��![]() ��ֵ����
��ֵ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com