
| A. | 因为SiO2是H2SiO3的酸酐,故SiO2溶于水得H2SiO3 | |
| B. | CO2通入水玻璃(Na2SiO3的水溶液)中可以得到硅酸沉淀 | |
| C. | 因为高温时发生反应:Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强 | |
| D. | SiO2是酸性氧化物,它不溶于任何酸 |
分析 A.二氧化硅不溶于水;
B.碳酸的酸性强于硅酸,依据强酸制取弱酸分析解答;
C.比较酸的酸性强弱应在常温下的水溶液中进行;
D.二氧化硅常温下能够与氢氟酸反应.
解答 解:A.二氧化硅不溶于水,与水不反应,故A错误;
B.碳酸的酸性强于硅酸,CO2通入水玻璃(Na2SiO3的水溶液)中反应生成碳酸钠和硅酸沉淀,故B正确;
C.高温下SiO2能与Na2CO3固体反应生成Na2SiO3和CO2,不是在常温下进行,且不是在水溶液中进行,不能说明硅酸的酸性强于碳酸,故C错误;
D.二氧化硅常温下能够与氢氟酸反应,生成四氟化硅和水,故D错误;
故选:B.
点评 本题考查了硅及其化合物,熟悉二氧化硅的性质是解题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
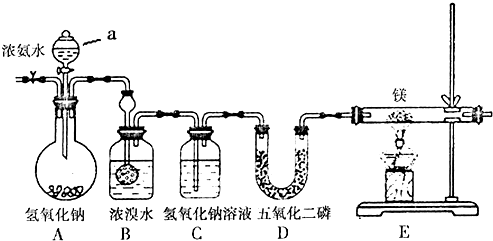
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1 | n(N2) | 0 | 0.20 | 0.35 | 0.40 | 0.40 |
| T2 | n(N2) | 0 | 0.25 | … | 0.30 | 0.30 |
| A. | T1温度下,CH4的平衡转化率为50% | |
| B. | T1<T2 | |
| C. | a<0 | |
| D. | T2时反应的平衡常数大于T1时反应的平衡常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCl2与足量 Fe 反应,转移的电子数为 3NA | |
| B. | 在常温常压下,1.7g NH3含有的原子数为 0.4NA | |
| C. | 标准状况下,11.2 L 水中含有的原子数是 1.5NA | |
| D. | 0.2 mol?L-1 的 Na2SO4溶液中含 Na+数目为 0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
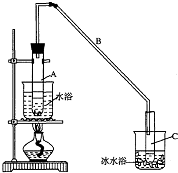 某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯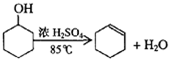
| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com