
【题目】除去镁粉中的少量铝粉,选用的试剂和操作都合理的是( )
A. 硫酸,蒸发 B. 盐酸,过滤
C. 氢氧化钠溶液,过滤 D. 氢氧化钠溶液,蒸发
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
【题目】(1)认识有机化合物的结构与类别有助于理解其性质。
①下列有机化合物与苯甲酸(![]() )互为同系物的是________(填字母,下同)。
)互为同系物的是________(填字母,下同)。
a. 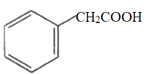 b.
b. 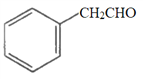 c.
c. 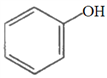
②下列有机化合物易溶于水的是________。
a. 苯 b. 乙烷 c. 乙醇
③下列试剂可用于鉴别乙酸和乙醛的是________。
a. 水 b. 银氨溶液 c. 稀硫酸
(2)扁桃酸(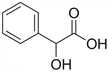 )是一种重要的化工原料。
)是一种重要的化工原料。
①扁桃酸分子中有________种不同化学环境的氢。
②扁桃酸中含氧官能团的名称为________和________。
③1 mol扁桃酸最多能与________mol金属钠反应
(3)化合物C是一种医药中间体,由A制备C的物质转化路线如下:
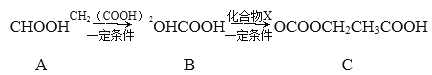
①1个A分子中一定共平面的碳原于有________个。
②B暴露在空气中易变色,其原因是___________________________________。
③化合物X的分子式为C3H5O2Cl,其结构简式为_________________________________。
④D是B的一种同分异构体。D能发生银镜反应,也能与NaHCO3溶液反应放出气体,且苯环上的一氯代物有2种。写出符合条件的D的一种结构简式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂和氮的相关化合物在化工、医药、材料等领域有着广泛的应用。请回答下列问题
(1)Li的氢标电势是最负的,达到-3.045V,与水有很大的反应倾向,然而将Li单质加入水中,其反应烈程度远不如其他碱金属,试解释原因___________________________
(2)基态氮原子中,核外电子占据的最高能层的符号为____________,核外电子能量最高的电子的电子云轮廓图形状为____________
(3)氮元素既可与其他元素形成正离子,比如N2O5结构中存在NO2+的结构,其空间构型为____________,氮原子的杂化形式为____________;它也可以形成全氮的正离子,比如 N5AsF6中存在高能量的N5+,N5+的空间构型为____________。
(4)下图为一种N和Li形成的二元化合物的晶体结构,试在图中划出其晶胞__________,该化合物的化学式为____________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和氮的化合物在生产、生活中广泛存在。请回答下列问题:
(1)资料显示,可用次氯酸钠处理废水中的氨氮(NH3),使其转化为氮气除去。其主要反应如下
I.NH3(aq)+ HClO(aq)= NH2 Cl(aq)+H2O(1)
II. 2NH2 Cl(aq)+HClO(aq)=N2(g) +H2O(1)+3HCl(aq)
①以上反应中HClO的来源用化学用语解释是__________________________________
②实验测得.废水中pH与氨氮去除率的关系如图所示。pH较高时,氨氮去除率下降的原因是____________________________________
 c
c
(2)甲酶是重要的化工原料,又可作为燃料,工业上可利用CO或CO2来生产燃料甲醇。已知制备甲醇的有关反应的化学方程式及其在不同温度下的化学平衡常数如下表所示。

①下列措施能使反应③的平衡体系中![]() 增大的是________(填字母代号)。
增大的是________(填字母代号)。
A.将H2O(g)从体系中分离出去 B.充人He(g),使体系压强增大
C.升高温度 D.恒容时再充入1mol H2 (g)
②500℃时测得反应③在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度分別为0.8mol·L-1、0.1mol·L-1、0.3mol·L-1、0.15mol·L-1,则此时v(正) ________ (填“>” “=”或“<”) v (逆)
(3)常温下,在(NH4)2C2O4溶液屮,反应NH4++C2O42-+H2O ![]() NH3·H2O+HC2O4ˉ的化学平衡常数K=____________。(已知:常温下,NH3·H2O的电离平衡常数Kb=2×10-5,H2C2O4的电离衡常数Ka1=5×10-2、Ka2=5×10-5)
NH3·H2O+HC2O4ˉ的化学平衡常数K=____________。(已知:常温下,NH3·H2O的电离平衡常数Kb=2×10-5,H2C2O4的电离衡常数Ka1=5×10-2、Ka2=5×10-5)
(4)电解硝酸上业的尾气NO可制备NH4NO3,其工作原理如图所示:

①阴极的电极反应式为____________________________________
②将电解生成的HNO3全部转化为NH4NO3,则通入的NH3与实际参加反应的NO的物质的量之比至少为_________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. 所有细胞中的化合物的含量是一样的
B. 所有细胞中化合物的种类都一样
C. 各种细胞中的元素种类完全一致
D. 细胞中都有蛋白质和核酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示。下列说法正确的是( )

A. 简单阳离子半径:X>R
B. X与Y可以形成正四面体结构的分子
C. M的氢化物常温常压下为液体
D. 最高价氧化物对应水化物的酸性:Z<Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝(熔点660℃)是一种应用广泛的金属,工业上用A12O3(熔点2045℃)和冰晶石(Na2AlF6,六氟合铝酸钠)混合熔融后电解制得。回答下列问题:
(l)铝属于活泼金属却能在空气中稳定存在,原因是(用化学用语及相关文字说明)_______.
(2)将0.1 mol/L AlCl3溶液和10%NH4F溶液混合制取Na2AlF6。该实验所用试管及盛装NaF 溶液的试剂瓶均为塑料材质,原因是____________。
(3)下列关于氧化铝的叙述正确的是_______
A.氧化铝可以治疗胃酸过多。
B.氧化铝因为熔点高,可以作耐火材料.
C.氧化铝是铝热剂的成分之一。
D.氧化铝是两性氧化物,所以既能溶于盐酸又能溶于氨水。
(4)某工厂排放出有毒物质NOCl , 它遇水就会生成NO3-。NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为_________。水源中的NO3-对人类健康会产生危害。为了降低水源中NO3-的浓度,有研究人员建议在碱性条件下用铝粉将NO3-还原为N2,该反应的离子方程式为_________,此方法的缺点是处理后的水中生成了A1O3-,仍然可能对人类健康产生危害,还需要对该饮用水进行一系列后续处理。
已知25℃时,Ksp[Al(OH)3] = l.3×l0-33 Al(OH)3![]() AlO2-+H++H2O K=1.0×10-13
AlO2-+H++H2O K=1.0×10-13
25℃时,若欲使上述处理后的水中A1O2-浓度降到1.0×10-6mol/L,则应调节至pH=_______。
此时水中c(A13+)=__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积的关系如图,下列说法正确的是( ) ①若a<4,则A、B 都是弱酸
②稀释后,A酸溶液的酸性比B酸溶液强
③若a=4,则A是强酸,B是弱酸
④A、B两种酸溶液的物质的量浓度一定相等.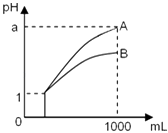
A.①④
B.②③
C.①③
D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com