
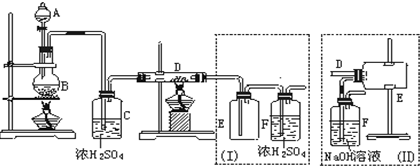
分析 (1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水;
(2)可以用生成的氯气排除装置中的空气;
(3)铁在氯气中燃烧生成氯化铁;
(4)装置(Ⅰ)的主要缺点是导管易被产品堵塞,有毒气体应该有尾气处理装置;
(5)尾气处理装置中有水,导致氯化铁易潮解;
(6)使分液漏斗与烧瓶内压强相等,则分液漏斗中液体能够顺利流下;
(7)浓盐酸易挥发,制取的氯气中含有氯化氢,所以生成产物含有氯化亚铁,依据氯化氢、氯气的溶解性选择合适的除杂剂除去氯化氢.
解答 解:(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,化学方程式:4HCl+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑;
故答案为:4HCl+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑;
(2)AB处是制取氯气,D是氯气和铁反应,所以先点B处酒精灯,B中的反应进行一段时间后,看到黄绿色气体充满装置,再开始加热D使制取的Cl2排尽装置内的空气,防止铁被空气中氧气氧化;故答案为:B中的反应进行一段时间后,看到黄绿色气体充满装置,再开始加热D;
(3)铁在氯气中燃烧生成氯化铁,化学方程式:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3;
故答案为:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3;
(4)装置(Ⅰ)的主要缺点是导管易被产品堵塞,有毒气体应该有尾气处理装置;
故答案为:导管易被产品堵塞;尾气排入空气,易造成环境污染
(5)该装置中有尾气处理装置,但尾气处理装置中是水溶液,会导致E中有水蒸气,会导致氯化铁产品易潮解,所以为防止氯化铁潮解,在瓶E和F之间连接装有干燥剂的装置;
故答案为:产品易受潮解,可在Ⅱ装置的瓶E和F之间连接装有干燥剂的装置;
(6)用导管将分液漏斗上口与烧瓶口相连或改用恒压滴液漏斗,使分液漏斗与烧瓶内压强相等,分液漏斗中液体则能够顺利流下,
故答案为:在A,B的装置间连接一个软橡皮管,平衡内外大气压;
(7)浓盐酸易挥发,制取的氯气中含有氯化氢,所以生成产物含有氯化亚铁,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,所以可以选择饱和氯化钠除去氯气中的氯化氢,
故答案为:在B,C 间加一个饱和的氯化钠水溶液.
点评 本题以氯化铁的制备为环境,考查了氯气的制备和性质的检验,解题关键理在于明确实验原理和目的及各装置的作用,题目难度中等.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MnO2与浓盐酸反应制Cl2:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O | |
| B. | Na2O2 溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| C. | 醋酸除去水垢:2H++CaCO3═Ca2++CO2↑+H2O | |
| D. | 新制的氧化铝可溶于氢氧化钠溶液:Al2O3+2OH-═2AlO2-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
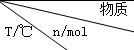 | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1mol NH5中含有5NA个N-H键(NA为阿伏加德罗常数) | |
| B. | NH5中既有共价键,又有离子键 | |
| C. | NH5的电子式为: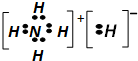 | |
| D. | 与水反应时,水作氧化剂,生成1mol氢气,转移2mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②③ | C. | ②④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
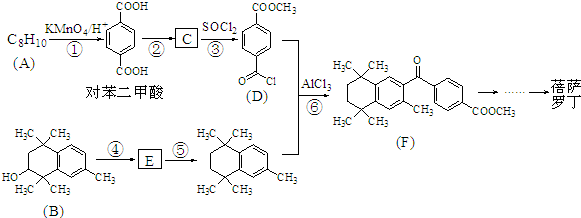
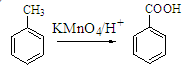 Ⅱ.
Ⅱ.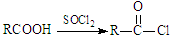
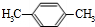 ,C的结构简式为
,C的结构简式为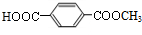 .
. ;⑤
;⑤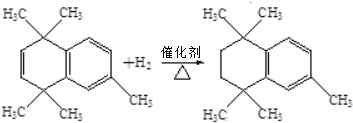 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com