
【题目】如图所示进行电化学实验,电极材料为铜和另一电极X,则以下说法中错误的是( )

A. 铜电极上既可能发生反应:Cu-2e- =Cu2+,又可能发生 Cu2++2e- =Cu
B. 该装置既可实现化学能转化成电能,又能实现电能转化成化学能
C. X电极上既可能产生H2,又可能产生O2
D. 该装置既可做电镀铜的实验,又可以研究精炼铜的原理
 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。
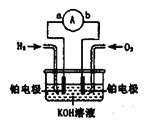
(1)氢氧燃料电池的能量转化形式主要是_______,在导线中电子流动方向为_____(用a、b和箭头表示)。
(2)负极反应式为__________。
(3)电极表面镀铂粉的原因为__________ 。
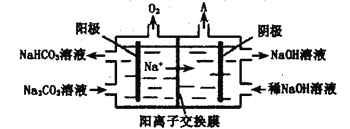
(4)使用上述电池电解(均为Pt电极)一定浓度的Na2CO3溶液,原理如下图所示。阳极的电极反应式为___________。
(5)氢气的制备和存储是氢氧燃料电池能否有效推广的关键技术。有人提出利用光伏发电装置电解尿素的碱性溶液来制备氢气。光伏发电是当今世界利用太阳能最主要方式之一。图1为光伏并网发电装置,图2为电解尿素[CO(NH2)2](C为+4价)的碱性溶液制氢的装置示意图(电解泄中隔膜可阻止气体通过,阴、阳极均为惰性电极)。
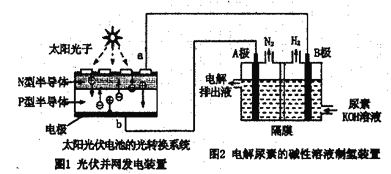
①图1中N型半导体为________(填“正极”或“负极”)。该系统工作时,A极的电极反应式为:CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O,若A极产生7.00gN2,则此时B极产生_____LH2(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实与对应的方程式不符合的是
A. 自然界中正常的雨水呈酸性:H2O+CO2![]() H2CO3 ,H2CO3
H2CO3 ,H2CO3![]() H++HCO3—
H++HCO3—
B. “NO2球”浸泡在冷水中,颜色变浅:2NO2(g) (红棕色)![]() N2O4 (g) (无色) ΔH<0
N2O4 (g) (无色) ΔH<0
C. 甲烷的燃烧热为-890.3 kJ·mol—1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
D. 硫代硫酸钠溶液与稀硫酸混合出现浑浊:S2O32-+2H+=S +SO2 +H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2017·天津卷)常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第二阶段,Ni(CO)4分解率较低
C. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钙的冶炼方法是电解法,这一事实说明了( )
A. 金属钙离子易得电子变成金属钙原子B. 金属钙是不活泼的金属元素
C. 金属钙原子易失去电子变成钙离子D. 金属钙离子的氧化性很强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验验证元素周期律。
Ⅰ.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成元素氮、碳、硅非金属性强弱比较的实验研究。已知A是强酸,B是块状固体。打开分液漏斗的活塞后,可看到有大量气泡产生,烧杯中可观察到白色沉淀生成。
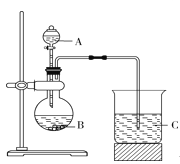
(1)甲同学设计实验的理论依据是_________________。
(2)写出选用的物质:A____________,B____________,C________(填化学式)。
(3)烧杯中反应的离子方程式为______________________。
(4)乙同学认为甲同学设计的实验不够严谨,应在B和C之间增加一个洗气装置,该装置中应盛放________(填试剂名称)溶液,目的是_____________________。
Ⅱ.丙同学设计了如图装置来验证卤族元素性质的递变规律。A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。
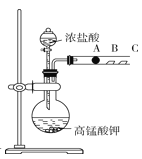
(5)A处的实验现象为_________;写出B处反应的离子方程式:____________;向NaBr和KI的混合溶液中,通入足量的Cl2充分反应后,将所得溶液蒸干并灼烧,最后得到的物质是_________。
(6)丙同学利用此实验证明卤素单质氧化性Cl2>Br2>I2,你认为此实验_____(填“合理”或“不合理”),理由是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】总的物质的量为0.50mol的Fe粉与Al粉混合物分为等质量的两份;在一份中加入足量的稀盐酸,在标准状况下产生气体aL;在另一份中加入足量的氢氧化钠溶液,在标准状况下产生气体bL。则a+b的数值不可能是( )
A. 5.6 B. 7.3 C. 8.2 D. 11.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ:为使空气质量达标,完成二氧化硫,氮氧化物排放量下降的目标,离不开各种化学处理方法。一定条件下,用CO处理燃煤烟气中的SO2可生成液态硫,实现硫的回收。
己知:2CO(g)+O2(g)![]() 2CO2(g)△H=-566kJ·mol-1
2CO2(g)△H=-566kJ·mol-1
S(l)+O2(g)![]() SO3(g)△H=-296kJ·mol-1
SO3(g)△H=-296kJ·mol-1
则用CO处理燃煤烟气中SO2的热化学方程式是___________________。
Ⅱ:如图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。根据要求回答相关问题:
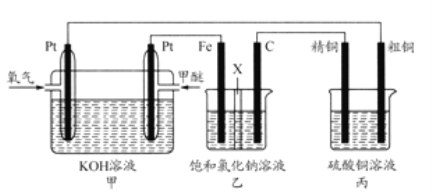
(1)甲醚燃料电池的负极反应式____________。
(2)石墨电极(C)的电极反应式为____________________________________。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将____________(填“增大”“减小”或“不变”)。
(4)若在标准状况下,有2.24L氧气参加反应,丙装置中阴极析出铜的质量为____________;则乙装置中生成标况下气体的体积为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com